枸地氯雷他定治疗慢性荨麻疹的效果
章 超1 张琳琳2 戴维维3 刘 洪3▲
1.江西省九江市第一人民医院药剂科,江西九江 332000;2.江西省九江经开区瑞丽医疗美容门诊部,江西九江 332000;3.江西省九江市第一人民医院皮肤科,江西九江 332000
[摘要] 目的 探讨枸地氯雷他定治疗慢性荨麻疹的效果。方法 选取2019 年1 月至2021 年1 月九江市第一人民医院皮肤科门诊收治的100 例慢性荨麻疹患者作为研究对象,采用随机数字表法将其分为对照组和研究组,每组各50 例。对照组患者给予氯雷他定片治疗。研究组患者给予口服枸地氯雷他定片治疗。两组患者均连续治疗28 d。比较两组患者治疗前、治疗14 d 及28 d 时的总分、瘙痒评分、风团数、风团大小、不同疗程总有效率以及转化生长因子-β1(TGF-β1)、免疫球蛋白 E(IgE)、T 细胞亚群和白介素 18(IL-18)水平。结果 两组患者治疗 14、28 d 的瘙痒评分、风团数评分、风团大小评分以及总分均低于本组治疗前,差异有统计学意义(P<0.05);研究组患者治疗14、28 d 的瘙痒评分、风团数评分、风团大小评分以及总分均低于对照组,差异有统计学意义(P<0.05)。 两组患者治疗28 d 的总有效率高于治疗14 d,差异有统计学意义(P<0.05);研究组患者治疗14、28 d 的总有效率高于对照组,差异有统计学意义(P<0.05);两组患者治疗 14、28 d 的 TGF-β1、IgE、IL-18、CD8+均低于本组治疗前,差异有统计学意义(P<0.05);研究组患者治疗 14、28 d 的 TGF-β1、IgE、IL-18、CD8+均低于对照组,差异有统计学意义(P<0.05)。 两组患者治疗 14、28 d 的 CD4+、CD4+/CD8+水平均高于本组治疗前,差异有统计学意义(P<0.05);研究组患者14、28 d 的CD4+、CD4+/CD8+水平均高于对照组,差异有统计学意义(P<0.05)。 结论 枸地氯雷他定能有效调控慢性荨麻疹患者的血清 TGF-β1、IgE、IL-18 以及 T 细胞亚群 CD4+、CD8+、CD4+/CD8+水平,具有较好的临床疗效。
[关键词]转化生长因子-β1;免疫球蛋白E;T 细胞亚群;白介素18;枸地氯雷他定;慢性荨麻疹
慢性荨麻疹(chronic urticaria,CU)难以控制,病程较长,在治疗上相对困难[1]。一种或多种抗组胺药通常用于临床治疗,效果不是很理想。 该病的治疗不局限于长期使用抗组胺药,可以透彻了解患者免疫系统的调节机制,从而更好地防止疾病复发[2]。枸地氯雷他定广泛应用于过敏性皮肤病的临床治疗中,并且具有治疗有效率高、不良反应发生率低的特点[3]。 CU 的发病机制中,自身免疫有多种类型的免疫细胞和分子共同参与, 这些细胞和分子主要有转化生长因子-β1(transforming growth factor-β1,TGF-β1)、免疫球蛋白E(immunoglobulin E,IgE)、T 细胞亚群和白介素 18(interleukin-18,IL-18)等[4-5]。 本研究探讨枸地氯雷他定在 CU 效果治疗中的应用价值,并观察 TGF-β1、IgE、T细胞亚群和IL-18 的变化,旨在进一步揭示枸地氯雷他定的作用机制,为CU 的临床治疗提供参考依据。
1 资料与方法
1.1 一般资料
选取2019 年1 月至 2021 年1 月九江市第一人民医院皮肤科门诊收治的100 例CU 患者作为研究对象, 采用随机数字表法将其分为对照组和研究组,每组各50 例。对照组中,男18 例,女32 例;平均年龄(46.12±5.23)岁;病程 3~10 年,平均(5.26±1.23)年;平均发病年龄(32.26±5.24)岁。 研究组中,男 20 例,女30 例;平均年龄(47.26±5.17)岁;病程 3~10 年,平均(5.17±1.09)年;平均发病年龄(32.09±5.18)岁。两组患者的一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经九江市第一人民医院医学伦理委员会审核及同意,患者均知晓本研究情况并签署知情同意书。
纳入标准:①患者年龄≥20 岁,CU 间歇发作,每次持续1~2 h,≥2 次/d,病程≥6 周;②患者皮肤划痕试验阳性;③患者符合CU 的诊断标准[6]和中医辨证标准[7];④患者在1 周内未使用抗组胺药,在4 周内未使用糖皮质激素和其他免疫抑制剂; ⑤患者均自愿参与研究。 排除标准:①胆碱能性、物理性荨麻疹者;②伴其他类型皮肤病者;③患有急性、慢性感染、心脏病、肝肾功能障碍,糖尿病、过敏性哮喘、癌症者;④患有荨麻疹以外的与过敏有关的疾病者;⑤孕期、哺乳期妇女;⑥皮肤划痕症、遗传性血管性水肿者。剔除及脱落标准:①不配合治疗和药物耐受性差者;②数据不完整者; ③由于某种原因而失访或自发脱落者;④由于不良事件终止治疗者。
1.2 方法
1.2.1 治疗方法 对照组患者给予氯雷他定片 (拜耳医药有限公司,国药准字H10970410,规格:10 mg,生产批号:20190311)10 mg,口服,每日 1 次,连续 28 d。
研究组患者给予口服枸地氯雷他定片(扬子江药业集团广州海瑞药业有限公司,国药准字H20090138,规格:8.8 mg,生产批号:20190405)8.8 mg,每日 1 次,连续28 d。
1.2.2 检测方法 治疗前、治疗14 d 及28 d 时,晨起空腹采集两组患者肘正中静脉血3 ml,采用双抗体夹心酶联免疫吸附法 (enzyme-linked immuno sorbent assay,ELISA)检测患者的 TGF-β1、IgE 和 IL-18 指标水平;采用流式细胞术检测患者外周血T 淋巴细胞亚群CD4+、CD8+T 淋巴细胞的数量及比例,计算CD4+/CD8+比值。
1.3 观察指标及评价标准
比较两组患者治疗前、 治疗14、28 d 时的总分、瘙痒评分、风团数、风团大小、不同疗程总有效率以及TGF-β1、IgE、T 细胞亚群和 IL-18 的水平。
治疗前、治疗 14、28 d 时,按 4 级评分法[1]分别记录患者风团大小、数目及瘙痒程度,将各项评分相加为总积分。 荨麻疹症状和体征的4 级评分标准:①瘙痒程度。0 分为无瘙痒,1 分为轻度瘙痒但不烦躁,2 分为中度瘙痒尚能忍受,3 分为严重瘙痒不能忍受;②风团大小(最大直径)。0 分为无风团,1 分为风团直径<0.5 cm,2 分为风团直径 0.5~2.0 cm,3 分为风团直径>2.0 cm;③风团数量。 0 分为无风团,1 分为风团数1~6 个,2 分为风团数 7~12 个,3 分为风团数>12 个。
根据随访的总积分计算症状积分下降指数(symptom score reduce index,SSRI),作为疗效判定标准。 SSRI=(治疗前总积分-治疗后总积分)/治疗前总积分×100%。 痊愈:SSRI≥90%;显效:60%≤SSRI<90%;有效:30%≤SSRI<60%;无效:SSRI<30%。总有效率=(痊愈+显效)例数/总例数×100%。
1.4 统计学方法
采用SPSS 20.0 统计学软件进行数据分析, 符合正态分布的计量资料用均数±标准差(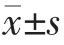 )表示,两组间比较采用独立样本t 检验,组内多时间点比较采用单因素方差分析, 组内两两比较采用配对样本t 检验;计数资料采用率表示,组间比较采用χ2 检验,以P<0.05 为差异有统计学意义。
)表示,两组间比较采用独立样本t 检验,组内多时间点比较采用单因素方差分析, 组内两两比较采用配对样本t 检验;计数资料采用率表示,组间比较采用χ2 检验,以P<0.05 为差异有统计学意义。
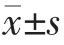 )表示,两组间比较采用独立样本t 检验,组内多时间点比较采用单因素方差分析, 组内两两比较采用配对样本t 检验;计数资料采用率表示,组间比较采用χ2 检验,以P<0.05 为差异有统计学意义。
)表示,两组间比较采用独立样本t 检验,组内多时间点比较采用单因素方差分析, 组内两两比较采用配对样本t 检验;计数资料采用率表示,组间比较采用χ2 检验,以P<0.05 为差异有统计学意义。2 结果
2.1 两组患者治疗前后不同时间瘙痒评分、 风团数评分、风团大小评分以及总分的比较
组内不同时间整体比较, 两组患者的瘙痒评分、风团数评分、风团大小评分以及总分比较,差异均有统计学意义(P<0.05);两组患者治疗 14、28 d 的瘙痒评分、风团数评分、风团大小评分以及总分均低于本组治疗前,差异有统计学意义(P<0.05);研究组患者治疗14、28 d 的瘙痒评分、风团数评分、风团大小评分以及总分均低于对照组,差异有统计学意义(P<0.05)(表 1)。
表1 两组患者治疗前后不同时间瘙痒评分、风团数评分、风团大小评分以及总分的比较(分,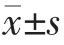 )
)
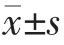 )
).jpg)
2.2 两组患者治疗后不同时间总有效率的比较
两组患者治疗28 d 的总有效率高于治疗14 d,差异有统计学意义(P<0.05);研究组患者治疗14、28 d的总有效率高于对照组,差异有统计学意义(P<0.05)(表 2)。
表2 两组患者治疗后不同时间总有效率的比较[n(%)]
.jpg)
2.3 两组患者治疗前后不同时间 TGF-β1、IgE、IL-18、CD4+、CD8+和 CD4+/CD8+水平的比较
组内不同时间整体比较,两组患者的TGF-β1、IgE、IL-18、CD4+、CD8+、CD4+/CD8+水平比较,差异均有统计学意义(P<0.05);两组患者治疗 14、28 d 的 TGF-β1、IgE、IL-18、CD8+均低于本组治疗前,差异有统计学意义(P<0.05);研究组患者治疗 14、28 d 的 TGF-β1、IgE、IL-18、CD8+均低于对照组,差异有统计学意义(P<0.05); 两组患者治疗 14、28 d 的 CD4+、CD4+/CD8+水平均高于本组治疗前,差异有统计学意义(P<0.05);研究组患者治疗 14、28 d 的 CD4+、CD4+/CD8+水平均高于对照组,差异有统计学意义(P<0.05)(表 3)。
表3 两组患者治疗前后不同时间 TGF-β1、IgE、IL-18、CD4+、CD8+和 CD4+/CD8+水平的比较(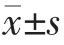 )
)
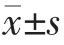 )
).jpg)
3 讨论
CU 属于一种水肿反应, 是皮肤和黏膜中的小血管扩张和皮肤通透性增加引起的。这种症状通常在发生后的1 d 内自行消退,然而症状消退后,新的皮疹易于复发,导致疾病持续时间较长。 尽管CU 不会直接威胁患者的生命,但症状仍在反复发作,并且疾病的进程是不可预测,对患者的工作、睡眠、情绪和社会交往产生了十分严重的影响。 大约3/4 的患者难以找到确切的病因,这给疾病的防治造成了很大的阻碍[8]。因此,关于CU 发病机制的研究以及监测相关指标的研究已引起皮肤科领域的高度关注。 现代医学认为,CU 是IgE 介导的I 型过敏, 也是一种自身免疫性疾病。除肥大细胞脱颗粒释放组胺外,CU 的发病机制还包括IgE 及其受体的自身抗体引发的自身免疫反应,Th1/Th2 细胞亚群的平衡状态被打破和炎性递质白三烯的释放引起随后的炎症反应[10]。 有研究结果显示[9],CU 发病机制中的自身免疫的关键环节是由抗IgE 受体α 链自身抗体或抗IgE 自身抗体介导的,很多类型的免疫细胞和分子参与进来。TGF-β1 是单核-巨噬细胞分泌的多肽调节剂,在人体的免疫防御机制中发挥着很大的作用。 在血清TGF-β1 单独存在的条件下,疾病的发生发展使TGF-β1 被诱导分化为Treg 细胞和Th17 细胞,参与 CU 发生[10]。 IgE 是过敏性疾病一项重要标志物,CU 患者受到变应原刺激后,产生IgE,其与血液循环中血管周围肥大细胞和嗜碱性粒细胞的对应受体结合, 并在变应原再次进入患者机体时与IgE特异性结合,触发一系列内部生化反应,患者的症状显现出来[11]。 T 淋巴细胞是参与细胞免疫的重要免疫调节细胞。 其中,CD4+和CD8+细胞反映了人体的细胞免疫状态, 是免疫反应调节至关重要的指标。 CD4+T细胞被提呈的抗原激活后,能成熟并分化为2 个不同的功能亚群:Th1 和 Th2,Th2 细胞可释放白介素(interleukin,IL)4、5 和 10 等,使 B 淋巴细胞和巨噬细胞活化,引起IgE 和组胺释放,并引起炎症和超敏反应,使得患者的皮肤受损[12]。 IL-18 是IL-1 不仅促进Th1细胞因子的分化,还促进Th2 细胞因子的分泌,并产生IgE 和IgG 抗体,引发立即过敏和嗜酸性粒细胞增多症。 有研究发现,CU 与 TGF-β1、IgE、IL-18 水平升高并参与免疫调控存在一定的联系[13]。
CU 难以控制,病程较长,治疗难度较大。 一种或多种抗组胺药通常用于临床治疗, 效果不是很理想。CU 患者的T 细胞亚群不失去平衡, 细胞因子网调节异常,调节人体的免疫状态是提高治疗效果的重要途径[14]。 枸地氯雷他定广泛应用于过敏性皮肤病的临床治疗中,并且具有治疗的有效率高、不良反应率低的特点[15]。
本研究探讨了枸地氯雷他定在CU 效果治疗中的应用价值,并观察 TGF-β1、IgE、T 细胞亚群和 IL-18的变化, 旨在进一步揭示枸地氯雷他定的作用机制,为CU 的临床治疗提供新的思路。 本研究结果显示,两组患者治疗14、28 d 的瘙痒评分、 风团数评分、风团大小评分以及总分均低于本组治疗前,差异有统计学意义(P<0.05);研究组患者治疗 14、28 d 的瘙痒评分、风团数评分、风团大小评分以及总分均低于对照组,差异有统计学意义(P<0.05)。两组患者治疗28 d的总有效率高于治疗14 d,差异有统计学意义(P<0.05);研究组患者治疗14、28 d 的总有效率高于对照组,差异有统计学意义(P<0.05);两组患者治疗 14、28 d 的 TGF-β1、IgE、IL-18、CD8+均低于本组治疗前,差异有统计学意义(P<0.05);研究组患者治疗 14、28 d 的 TGF-β1、IgE、IL-18、CD8+均低于对照组,差异有统计学意义 (P<0.05)。 两组患者治疗 14、28 d 的CD4+、CD4+/CD8+水平均高于本组治疗前,差异有统计学意义(P<0.05);研究组患者 14、28 d 的 CD4+、CD4+/CD8+水平均高于对照组,差异有统计学意义(P<0.05)。 提示枸地氯雷他定对 CU 患者血清 TGF-β1、IgE、IL-18 以及 T 细胞亚群 CD4+、CD8+、CD4+/CD8+水平可进行有效调控,从而改善机体的免疫状态,促进CU 患者症状的改善。
然而,本研究存在一定的局限性,样本量较少,临床疗效观察时间较短,远期疗效不清楚,检测的指标还不够全面, 其他细胞因子也参与了CU 的发病机制,但本文研究未检测。在以后的研究中,将扩大样本量,增加治疗时间和相关细胞因子的检测.更好的探讨枸地氯雷他定治疗CU 的可能作用机制。
综上所述,枸地氯雷他定能有效调控CU 患者的血 清 TGF-β1、IgE、IL-18 以 及 T 细 胞 亚 群 CD4+、CD8+、CD4+/CD8+水平,具有较好的临床疗效。
[参考文献]
[1]王振.枸地氯雷他定递减疗法治疗慢性荨麻疹的疗效观察及对血清总 IgE 水平的影响[J].临床研究,2019,27(12):68-69.
[2]孙杰.枸地氯雷他定片治疗慢性荨麻疹的效果及对血清总 IgE 水平的影响研究[J].皮肤病与性病,2020,182(3):128-129.
[3]谢枝刚.枸地氯雷他定治疗慢性荨麻疹的效果及用药安全性观察[J].医学理论与实践,2020,33(20):91-92.
[4]孙权.枸地氯雷他定治疗慢性荨麻疹疗效及对血清IgE水平的影响[J].皮肤病与性病,2019,41(5):717-719.
[5]徐延峰,杜威萍,骆志成,等.枸地氯雷他定治疗慢性荨麻疹的疗效及对血清白细胞介素 23 和 33、 趋化因子PARC/CCL-18 的影响[J].中华皮肤科杂志,2019,52(5):337-339.
[6]王尧绍.皮肤病学[M].3 版.北京:人民卫生出版,1993:56.
[7]国家中医药总局.中医病证诊断疗效标准[S].南京:南京大学出版社,1994:265.
[8]黎舒敏,邱鸿琳,周俊琳.慢性荨麻疹患者发病影响因素与中医体质的相关性分析[J].中国初级卫生保健,2020,34(2):84-86.
[9]Kolkhir P,Pogorelov D,Darlenski R,et al.Management of chronic spontaneous urticaria:a worldwide perspective[J].World Allergy Organ J,2018,11(1):14.
[10]肖显俊,石云舟,张镭潇,等.慢性荨麻疹相关基因研究进展[J].中国皮肤性病学杂志,2020,34(1):98-101.
[11]何沅莉,单葵,曹雨微,等.慢性荨麻疹患者血清 IL-17、IL-23、TGF-β 水平检测分析[J].现代医药卫生,2018,34(3):364-365,368.
[12]吕纯鹏,康尔恂.慢性自身免疫性荨麻疹研究进展[J].国际皮肤性病学杂志,2016,42(4):233-235.
[13]杜威萍,徐延峰,张保恒.润肤止痒汤联合枸地氯雷他定治疗慢性荨麻疹的疗效观察及其对炎症因子和RANTES、MCP-1 的影响[J].中国中医药科技,2019,26(5):651-654.
[14]EL-Mezayen RE,Matsumoto T.In vitro responsiveness to IL-18 in combination with IL-12 or IL-2 by PBMC from patients with bronchial asthma and atopic dermatitis[J].Clin Immunol,2004,111(1):61-68.
[15]赵星云,张杰,黄海艳,等.联合用药治疗慢性自发性荨麻疹新进展[J].海南医学,2018,29(18):2585-2587.
Effect of Desloratadine Citrate Disodium in the treatment of chronic urticaria
ZHANG Chao1 ZHANG Lin-lin2 DAI Wei-wei3 LIU Hong3▲
1. Department of Pharmacy, Jiujiang First People′s Hospital, Jiangxi Province, Jiujiang 332000, China; 2. Department of Out-patient, Jiujiang Economic Zone Ruili Medical Cosmetology Center, Jiangxi Province, Jiujiang 332000, China;3. Department of Dermatology, Jiujiang First People′s Hospital, Jiangxi Province, Jiujiang 332000, China
1. Department of Pharmacy, Jiujiang First People′s Hospital, Jiangxi Province, Jiujiang 332000, China; 2. Department of Out-patient, Jiujiang Economic Zone Ruili Medical Cosmetology Center, Jiangxi Province, Jiujiang 332000, China;3. Department of Dermatology, Jiujiang First People′s Hospital, Jiangxi Province, Jiujiang 332000, China
[Abstract] Objective To explore the effect of Desloratadine Citrate Disodium on chronic urticaria. Methods A total of 100 patients with chronic urticaria who were admitted to the Department of Dermatology of Jiujiang First People′s Hospital from January 2019 to January 2021 were selected as subjects and divided into the control group and the study group by the random number table method, with 50 patients in each group. The control group was treated with Loratadine Tablets, and the study group was treated with oral Desloratadine Citrate Disodium Tablets. Both groups were treated continuously for 28 days. The total score, pruritus score, wheal number, wheal size, total effective rate of different treatment courses and the levels of transforming growth factor-β1 (TGF-β1), immunoglobulin E (IgE), T cell subsets and interleukin-18 (IL-18) were compared between the two groups before treatment, 14 and 28 days after treatment. Results The pruritus scores, wheal number scores, wheal size scores and total scores of the two groups at 14 and 28 d after treatment were lower than those before treatment, with statistically significant differences (P<0.05). The pruritus score, wheal number score, wheal score and total score of the study group were all lower than those of the control group at 14 and 28 d after treatment, with statistically significant differences (P<0.05). In the two groups, the total effective rates at 28 d after treatment were higher than those at 14 d after treatment, with statistically significant differences (P<0.05). The total effective rates in the study group were higher than those in the control group at 14 and 28 d after treatment, with statistically significant differences (P<0.05). The TGF-β1, IgE, IL-18 and CD8+ in the two groups at 14 and 28 d after treatment were lower than those before treatment, with statistically significant differences (P<0.05). The TGF-β1, IgE IL-18 and CD8+in the study group were lower than those in the control group at 14 and 28 d after treatment, with statistically significant differences (P<0.05).The levels of CD4+ and CD4+/CD8+ in the two groups at 14 and 28 d after treatment were higher than those before treatment, with statistically significant differences (P<0.05).The levels of CD4+ and CD4+/CD8+ in the study group were higher than those in the control group at 14 and 28 d after treatment, with statistically significant differences (P<0.05). Conclusion Desloratadine Citrate Disodium can effectively regulate the levels of serum TGF-β1, IgE, IL-18 and T cell subsets of CD4+, CD8+, and CD4+/CD8+ in patients with chronic urticaria, showing good clinical efficacy.
[Key words] Transforming growth factor-β1; Immunoglobulin E; T cell subsets; Interleukin-18; Desloratadine Citrate Disodium; Chronic urticaria
[中图分类号] R758.24
[文献标识码] A
[文章编号] 1674-4721(2021)12(a)-0162-05
[基金项目]江西省卫生健康委科技计划项目(202140257)。
▲通讯作者
(收稿日期:2021-03-08)