血清铁调素水平在脑梗死首发患者中的表达及临床意义
孙 玙 何杏玲 杨水泉
广东省佛山市三水区人民医院神经内科,广东佛山 528100
[摘要]目的 探讨血清铁调素水平在脑梗死首发患者中的表达及临床意义。方法 选取我院2017年10月~2019年8月脑梗死首发患者117 例为观察组,选取117 例健康体检者为对照组,检测发病后1、3、5、7、14 及28 d 两组血清铁调素含量的变化情况。观察组入院当天采用美国国立卫生研究院脑卒中量表(NIHSS)评估患者病情严重程度,分为轻型(n=42)、中型(n=41)、重型(n=34)三组;发病3 个月随访时采用改良Rankin 量表(mRS)评估患者神经功能恢复情况,分为预后好组(n=64)、预后差组(n=53)。比较观察组与对照组不同时间点血清铁调素水平动态变化。分析观察组血清铁调素水平与神经功能缺损程度及预后的关系。结果 观察组发病后第1、3、5、7、14、28 d的血清铁调素水平均高于对照组,差异有统计学意义(P<0.05)。观察组的轻、中、重型血清铁调素水平高于对照组,中、重型血清铁调素水平均高于轻型,重型血清铁调素水平均高于中型,差异均有统计学意义(P<0.05)。观察组中预后良好患者发病后第1、3、5、7、14、28 d 的血清铁调素水平均低于预后差患者,差异有统计学意义(P<0.05)。结论 脑梗死后神经功能缺损程度越重血清铁调素表达越高,预后越差血清铁调素表达越高,血清铁调素水平与脑梗死的发生、病情严重程度、预后密切相关。
[关键词]脑梗死;血清铁调素;表达;临床意义
急性脑梗死是最常见的急性脑血管疾病,有较高的病死率和致残率[1]。文献报道,铁蛋白及铁调素与脑梗死之间存在密切关系[2],其毒性作用是导致继发性脑损害的重要因素[3]。有实验研究通过调节缺血性脑卒中的铁代谢可发挥神经保护作用[4]。铁调素是维持细胞铁代谢平衡的主要铁调节多肽激素,血浆铁浓度的稳定主要依赖转铁蛋白结合铁对铁调素的反馈刺激[5]。目前关于铁调素在脑梗死中的具体变化和作用尚不明确,相关临床研究报道不多。本研究旨在通过观察脑梗死患者血清铁调素动态变化,分析与神经功能缺损及预后的相关性,为后续进一步研究脑梗死后铁调素在脑铁代谢中的作用机制奠定基础,现报道如下。
1 资料与方法
1.1 一般资料
选取2017年10月~2019年8月佛山市三水区人民医院收治的117 例脑梗死患者为观察组,纳入标准:初次发病,发病时间在24 h 内,伴有神经功能缺损,头颅CT 和(或)MRI 已确诊,与全国第四届脑血管病学术会议诊断标准相符合[6]。排除标准:伴有心力衰竭、血液病、慢性炎症、严重肝肾功能损害、恶性肿瘤及近30 d使用免疫抑制剂药物及抗炎药物者;既往有脑卒中并遗留明显后遗症;伴有脑出血的患者[7]。观察组中,男60 例,女57 例;年龄54~77 岁,平均(65.16±5.89)岁。观察组在入院时根据美国卫生研究院脑卒中量表(NIHSS)评分,并分为轻型42 例(NIHSS<4分)、中型脑梗死41 例(4 分≤NIHSS 评分<15 分)、重型脑梗死34 例(NIHSS 评分≥15 分)。同时,所有观察组患者在发病3 个月后根据改良Rankin 量表(mRS)评分[8]分为预后好组64 例(mRS>2 分),预后差组53 例(mRS≤2分)。另选取同期健康体检者117 例为对照组,其中男60例,女57例;年龄54~77 岁,平均(66.03±6.25)岁。观察组与对照组的一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究所有人员家属均签署知情同意书,且本研究经医院医学伦理委员会审核批准。
1.2 研究方法
所有研究对象于清晨采集静脉血5 ml,利用酶联免疫吸附测定法检测健康体检者及观察组患者发病后1、3、5、7、14、28 d 的血清铁调素含量,严格按试剂盒说明书进行操作(上海双赢生物科技有限公司,生产批号:20170915)。
1.3 观察指标
比较观察组和对照组血清铁调素水平的表达;比较观察组中轻型、中型、重型脑梗死组血清铁调素水平的表达;比较观察组中预后好组和预后差组血清铁调素水平的表达。
1.4 统计学方法
采用SPSS 21.0 统计学软件进行数据分析,计量资料采用均数±标准差(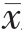 ±s)表示,两组间比较采用t 检验,多组间比较采用单因素方差分析;计数资料用率表示,组间比较采用χ2 检验,P<0.05 为差异有统计学意义。
±s)表示,两组间比较采用t 检验,多组间比较采用单因素方差分析;计数资料用率表示,组间比较采用χ2 检验,P<0.05 为差异有统计学意义。
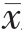 ±s)表示,两组间比较采用t 检验,多组间比较采用单因素方差分析;计数资料用率表示,组间比较采用χ2 检验,P<0.05 为差异有统计学意义。
±s)表示,两组间比较采用t 检验,多组间比较采用单因素方差分析;计数资料用率表示,组间比较采用χ2 检验,P<0.05 为差异有统计学意义。2 结果
2.1 观察组与对照组血清铁调素的比较
观察组患者发病后1、3、5、7 d 血清铁调素水平逐渐升高,7 d 时达到最高峰,14、28 d 血清铁调素水平逐渐下降,观察组患者发病3、5、7、14、28 d 的血清铁调素水平高于1 d,差异有统计学意义(P<0.05);观察组发病后1、3、5、7、14、28 d 的血清铁调素水平均高于对照组,差异有统计学意义(P<0.05)(表1)。
2.2 观察组轻型、中型、重型脑梗死患者血清铁调素的比较
观察组的轻、中、重型脑梗死患者血清铁调素水平高于对照组,差异均有统计学意义(P<0.05);中、重型脑梗死患者血清铁调素水平均高于轻型脑梗死患者,差异有统计学意义(P<0.05);重型脑梗死患者的血清铁调素水平均高于中型脑梗死患者,差异有统计学意义(P<0.05)(表2)。
表1 观察组与对照组血清铁调素的比较(ng/ml,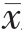 ±s)
±s)
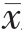 ±s)
±s).jpg)
与发病后1 d 比较,*P<0.05
表2 观察组不同神经功能缺损程度患者血清铁调素的比较(ng/ml,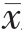 ±s)
±s)
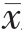 ±s)
±s).jpg)
与对照组比较,aP<0.05;与轻型脑梗死组比较,bP<0.05;与中型脑梗死组比较,cP<0.05
2.3 观察组中预后好组、预后差组血清铁调素水平比较
两组发病后3、5、7、14、28 d 的血清铁调素水平与发病后1 d 比较,差异均有统计学意义(P<0.05);预后好组的患者发病后1、3、5、7、14、28 d 的血清铁调素水平均低于预后差患者,差异有统计学意义(P<0.05)(表3)。
3 讨论
有研究表明,脑缺血发生与铁超载有关,大鼠大脑中动脉闭塞侧脑组织中发现了铁调素和铁蛋白的表达增高[9]。研究报道,脑细胞代谢过程有铁离子参与,铁离子水平过低或者过高均会引起脑组织损伤[10]。脑缺血时,自由铁会加速细胞中氧自由基生成,加快脂质过氧化反应而使神经细胞的损伤及凋亡加速,脑缺血进一步加重[3]。
表3 观察组不同预后患者血清铁调素的比较(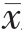 ±s,ng/ml)
±s,ng/ml)
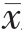 ±s,ng/ml)
±s,ng/ml).jpg)
与发病后1 d 比较,*P<0.05
铁调素是重要的多肽铁调节激素,其通过调控肠道铁的吸收、血清铁的浓度和组织铁的分布等在机体铁代谢平衡的调控中具有重要的作用[11],铁调素升高会抑制脑微血管内皮细胞内铁离子外排入血减少而产生毒性作用[4]。已有研究发现铁调素在脑梗死后疾病的发生发展中发挥着重要的作用[12]。铁调素及铁代谢的变化可能影响脑梗死的病情及预后[13]。
在此理论基础之上,本研究针对性的探讨了脑梗死患者铁调素的动态变化,及与神经功能缺损及预后结局的相关性。本研究发现观察组患者血清铁调素水平均高于对照组,差异有统计学意义(P<0.05)。可能机制为:①脑梗死后出现缺血再灌注可以诱导脑组织中铁调素的表达增加[14]。②由于脑缺血早期存在的炎症刺激可以促进铁调素的表达,血清铁调素的表达升高可能与脑梗死后炎性反应有关[15]。另外,患者的铁调素水平随着病程逐渐升高,7 d 时达到最高峰,14、28 d 时逐渐下降,28 d 时基本接近于对照组,但仍高于对照组水平。这个变化过程与脑梗死后炎性反应的高峰时间点相似,提示血清铁调素的表达升高可能与急性脑梗死病程进展及炎性反应有关。脑梗死后血清铁调素表达明显增高,并随脑缺血高峰逐渐递增,随着病程的发展和炎性反应的减少,其表达亦会逐渐下降。
此外,本研究通过对脑梗死患者的神经功能缺损程度及预后进行分析发现,神经功能缺损程度越重,预后越差的脑梗死患者,铁调素水平就越高,且不同神经损伤程度、不同预后的血清铁调素水平具有显著性差异。说明血清铁调素水平对脑梗死后神经功能缺损程度及预后情况均有较高的影响作用。其可能机制为发生脑梗死时,血清铁调素大量表达使神经细胞内铁大量蓄积,从而加速细胞损伤和凋亡。
综上所述,血清铁调素水平在急性脑梗死患者早期呈动态变化,与患者预后有关,血清铁调素是能够在一定程度上反映出脑梗死预后的生物学指标。本研究还存在一定的局限性,如样本量偏少,脑梗死后铁代谢复杂,血清铁调素增加水平对患者神经功能缺损及预后结局的贡献度仍不清楚等问题,尚需要进一步深入研究。
[参考文献]
[1]Azmin S,Osman SS,Mukari S,et al.Cerebral amyloid angiopathy:an important differential diagnosis of stroke in the elderly[J].Malays J Med Sci,2015,22(1):74-78.
[2]Garcia-Yebenes I,Sobrado M,Moraga A,et al.Iron overload,measured as serum ferritin,increases brain damage induced by focal ischemia and early reperfusion[J].Neurochem Int,2012(61):1364-1369.
[3]Reichert CO,da Cunha J,Levy D,et al.Hepcidin:homeostasis and diseases related to iron metabolism[J].Acta Haematol,2017,137(4):220-236.
[4]Zhao Y,Xin Z,Li N,et al.Nano-liposomes of lycopene reduces ischemic brain damage in rodents by regulating iron metabolism[J].Free Radic Biol Med,2018,8(20):124.
[5]赵晋英,李艳伟.铁代谢红细胞系调节因子与铁稳态[J].中国生物化学与分子生物学报,2019,35(5):486-492.
[6]中华神经科学会,中华神经外科学会.各类脑血管疾病诊断要点[J].中华神经科杂志,1996,29(6):379-380.
[7]Ois A,Martinez-Rodriguez JE,Munteris E,et al.Steno-occlusive arterial disease and early neurological deterioration in acute ischemic stroke[J].Cerebrovasc Dis,2008(25):151-156.
[8]张世洪,吴波.谈颂卒中登记研究中指数和改良的量表的适用性与相关性研究[J].中国循证医学杂志,2004,4(12):871-874.
[9]Yang L,Zhang B,Yin L,et al.Tanshinone ⅡA prevented brain iron dysshomeostasis in cerebral ischemic rats[J].Cell Physiol Biochem,2011,27(1):23-30.
[10]顾杰.脑出血患者血清铁蛋白水平与脑水肿发生的相关性[J].心脑血管病防治,2016,16(3):200-202.
[11]Ganz T,Nemeth E.Hepcidin and iron homeostasis[J].BBAMol Cell Res,2012,1823(9):1434-1443.
[12]Ding H,Yan CZ,Shi H,et al.Hepcidin is involved in iron regulation in the ischemic brain[J].PLoS One,2011(6):e25324.
[13]孔德燕,黄振华,王凯华.急性缺血性脑卒中患者血清铁调素25 及铁代谢指标变化及临床意义[J].中华老年心脑血管病杂志,2015,17(5):455-458.
[14]GanzT,NemethE.Hepcidinanddisordersofironmetabolism[J].Annu Rev Med,2011,62:347-360.
[15]Habib A,Polavarapu R,Karmali V,et al.Hepcidin-ferroportin axis controls toll-like receptor 4 dependent macrophage inflammatory responses in human atherosclerotic plaques[J].Atherosclerosis,2015,241(2):692-700.
Expression and clinical significance of serum ferritin level in patients with initial cerebral infarction
SUN Yu HE Xing-Ling YANG Shui-quan
Department of Neurology,Sanshui District People′s Hospital of Foshan City,Guangdong Province,Foshan 528100,China
Department of Neurology,Sanshui District People′s Hospital of Foshan City,Guangdong Province,Foshan 528100,China
[Abstract] Objective To explore the expression and clinical significance of serum ferritin level in patients with initial cerebral infarction. Methods A total of 117 patients with cerebral infarction from October 2017 to August 2019 were selected as the observation group and 117 healthy people as the control group.Serum samples were obtained on 1,3,5,7,14 d and 28 d to detect the levels of hepcidin,observation group were further divided into light group (n=42),moderate group (n=41) and heavy group (n=34) according to their NIHSS scores.The modified Rankin scale (mRS) was evaluated at 3 months after cerebral infarction.According to the mRS scores,the patients were divided into good prognosis group (n=64) and poor prognosis group (n=53).The changes of serum ferritin level were compared between the observation group and the control group at different time points.The relationship between serum hepcidin level and neurological deficit and prognosis in the observation group was analyzed. Results The levels of serum ferritin in the observation group were higher than those in the control group on the 1,3,5,7,14 d and 28 d after the onset of the disease (P<0.05).The levels of light,moderate and heavy serum ferritin in the observation group were higher than those in the control group,and the levels of moderate and heavy serum ferritin were higher than those in the light group,the level of heavy serum ferritin was higher than that in the moderate group,and the differences were statistically significant (P<0.05).In the observation group,the levels of serum ferritin water on the 1,3,5,7,14 d and 28 d after the onset of the disease were lower than those of the patients with poor prognosis,the differences were statistically significant(P<0.05).Conclusion After cerebral infarction,the expression of serum ferritin increased,and the more serious the degree of neurological impairment,the worse the prognosis,the more obvious the expression,the level of serum ferritin is closely related to the occurrence,severity and prognosis of cerebral infarction.
[Key words] Cerebral infarction;Serum hepcidin;Expression;Clinical significance
[中图分类号] R743
[文献标识码] A
[文章编号] 1674-4721(2020)7(c)-0064-03
[基金项目]广东省佛山市科技计划项目(2016AB001405)
(收稿日期:2019-12-31)