基于GC-MS技术研究地芬诺酯对大鼠肝脏组织代谢的影响
许慧芳
广东省珠海市妇幼保健院药学部,广东珠海 519000
[摘要]目的 研究地芬诺酯对大鼠肝脏组织代谢的影响。方法 将32 只SD 大鼠随机分为四组:地芬诺酯给药组(低、中、高三个剂量组)和对照组,每组8 只,采集肝组织气相色谱-质谱(GC-MS)图谱,用偏最小二乘判别分析(PLS-DA)进行分析,找出差异代谢产物。结果 与对照组比较,地芬诺酯组肝组织中丁酸、丙酸、甘油、亮氨酸、甘氨酸、L-天冬氨酸、谷氨酰胺、木酮糖、赤藓糖、9H-嘌呤、葡萄糖酸、D-甘露醇、半乳糖、花生四烯酸肝组织代谢物水平均升高,而肌醇水平下降(P<0.05)。结论 这些代谢物的变化表明给药后的大鼠氨基酸代谢、脂类代谢和能量代谢都发生了异常,该研究可为地芬诺酯肝脏代谢提供有用信息。
[关键词]代谢组学;气相色谱质谱联用;地芬诺酯;肝毒性
地芬诺酯是哌替啶的衍生物,可作为阿片类药物的替代品[1]。地芬诺酯片的正常使用不会使人上瘾,因此不在严格控制药物之列,患者很容易在药店和医院买到。在没有麻醉剂的情况下,吸毒者可能会购买大量的地芬诺酯片作为替代品,而大剂量长期服用地芬诺酯会导致中毒[2-4]。气相色谱-质谱法(gas chromatography-mass spectrometry,GC-MS)不仅具有广谱测定、分离复杂混合物的能力,而且具有较高的灵敏度、良好的重复性和线性响应,加上其庞大的化合物库,为鉴定工作带来了极大的便利[5-6]。近年来,GC-MS 已广泛应用于人类和动物的代谢组学研究,其目的是为了发现毒理学和生物标志物,进行疾病的诊断和分类[7-8]。Wen 等[9]为氯胺酮滥用后的大脑组织提供有用的生物标志物。本研究基于GC-MS 的代谢组学技术,旨在探讨大鼠灌胃地芬诺酯后所引起的肝毒性,以期能为临床用药给予一定的帮助,现报道如下。
1 材料与方法
1.1 仪器与条件
Agilent 自动进样器在不分流模式下加入1.0 μl最终衍生物。色谱分离采用安捷伦6890N 气相色谱仪,色谱柱为HP-5MS(30 m,i.d.,0.25 μm,0.25 mm)。柱温箱温度设定为100℃,恒定5 min,然后以10℃/min的速度上升到300℃,并保持恒定10 min。质谱检测采用电子轰击电离(EI)模式,电子能量为70 eV,离子源温度为250℃,然后在50~550 m/z 的质量范围内,以1 scan/s 的速度采集样品。
1.2 主要药物与试剂
地芬诺酯购于上海宸功生物技术有限公司;N-甲基-N-(三甲基硅烷基)三氟乙酰胺(MSTFA)和三甲基氯硅烷(TMCS)购于Sigma;乙腈购于天津市康科德科技有限公司。
1.3 动物处理和样品采集
32 只体重(220±20)g 雄性SD 大鼠[合格证号:SYXK(浙)2015-0009]均来自温州医科大学实验动物研究中心,置于自然光照黑暗循环的(22±2)℃环境中。所有涉及动物及其护理的操作均按照《实验动物护理原则》和《温州医科大学实验动物护理使用指南》执行。实验前1 周适应后,将大鼠随机分为低剂量组、中剂量组、高剂量组和对照组,每组8 只。将地芬诺酯按12、24、48 mg/ml 三种浓度溶解于玉米油中,地芬诺酯组(低、中、高剂量组)每天早晨分别灌胃地芬诺酯12、24、48 mg/kg,连续7 d。对照组按同样方法给予生理盐水。第8 天上午处死大鼠,取肝组织保存于-80℃冰箱。
样品提取和衍生化方法:称取100 g 冷冻肝组织,加入预冷250 μl 乙腈沉淀蛋白[10]。然后使用SCIENTZ-48 组织磨机研磨2 min,研磨参数为64 Hz,1800 r/min。再将EP 管涡旋混合1 min,冰浴15 min,4℃10 000 g离心10 min。取200 μl 上清液真空冷冻干燥24 h。冻干粉在70 ℃下加入50 μl 甲基羟胺盐酸盐(15 mg/ml,吡啶)1 h,然后加入50 μl MSTFA(以1% TMCS 为催化剂),加入150 μl 正庚烷后终止衍生化。
1.4 数据处理和模式识别
对地芬诺酯组和对照组的肝组织进行GC-MS 分析。信噪比>3 的峰被采纳。这些峰被放入NIST2010质谱数据库中进行检索。鉴定结果采取匹配度在70%以上的代谢物。为了补偿样品浓度的差异,对代谢物数据进行归一化处理。采用独立样本t 检验统计比较代谢物水平,找出不同的化合物。以P<0.05 为差异有统计学意义。将标准化值导入SIMCA-P+11.0 软件(Umetrics,Umea,瑞典),采用PLS-DA 多因素分析方法对地芬诺酯组与对照组进行分析。PLS-DA 模型由三个参数(R2X,R2Y,Q2Y)来界定。计算参数R2 和Q2,检验拟合优度和模型有效性。R2 和Q2 越接近1,表明该模型的有效性越高。
2 结果
2.1 各组大鼠肝组织的质谱分析
对32 只大鼠肝组织样品进行了基于质谱的代谢物谱分析,包括地芬诺酯组(低、中、高剂量组)和对照组,共观察到60 个质谱峰。
四组大鼠肝脏样品的代表GC-MS 图谱如图1(封三)所示。通过与NIST 质谱数据库中化合物的标准离子碎片的质荷比和丰度的比较,确定了它们的特征离子碎片谱。参考国外相关文献NIST 数据库所提供的标准光谱图[11-12]、化合物名称、结构、分子式、分子量、匹配度和相似性等信息,对代谢产物进行了最终鉴定。化合物主要为氨基酸、脂肪酸、糖类、酯类、胆固醇等内源性代谢产物。
2.2 各组大鼠肝组织代谢组学的分析
PLS-DA 的得分图显示了四组的肝脏样本散点分布,其中中剂量组大鼠点分布于低剂量组大鼠点中(图2A,封三)。与PLS-DA 相对应的载荷图揭示了与得分图对应的贡献较大的代谢物(图2B,封三)。置换试验的验证图表明,地芬诺酯组和对照组的PLS-DA模型是有据的和可信的(图2C,封三)。基于不同给药浓度后肝脏GC-MS 数据的PLS-DA 轨迹如图2D(封三)所示。
2.3 大鼠肝组织代谢物相对水平的变化
为了进一步探索代谢产物,PLS-DA 模型中第一主成分的重要度在各变量中的投影值(VIP>1),并结合t 检验找出差异代谢产物。与对照组比较,地芬诺酯组肝组织中丁酸、丙酸、甘油、亮氨酸、甘氨酸、L-天冬氨酸、谷氨酰胺、木酮糖、赤藓糖、9H-嘌呤、葡萄糖酸、D-甘露醇、半乳糖、花生四烯酸肝组织代谢物水平均升高,而肌醇水平下降(P<0.05)(表1)。
表1 大鼠肝组织代谢物相对水平的变化
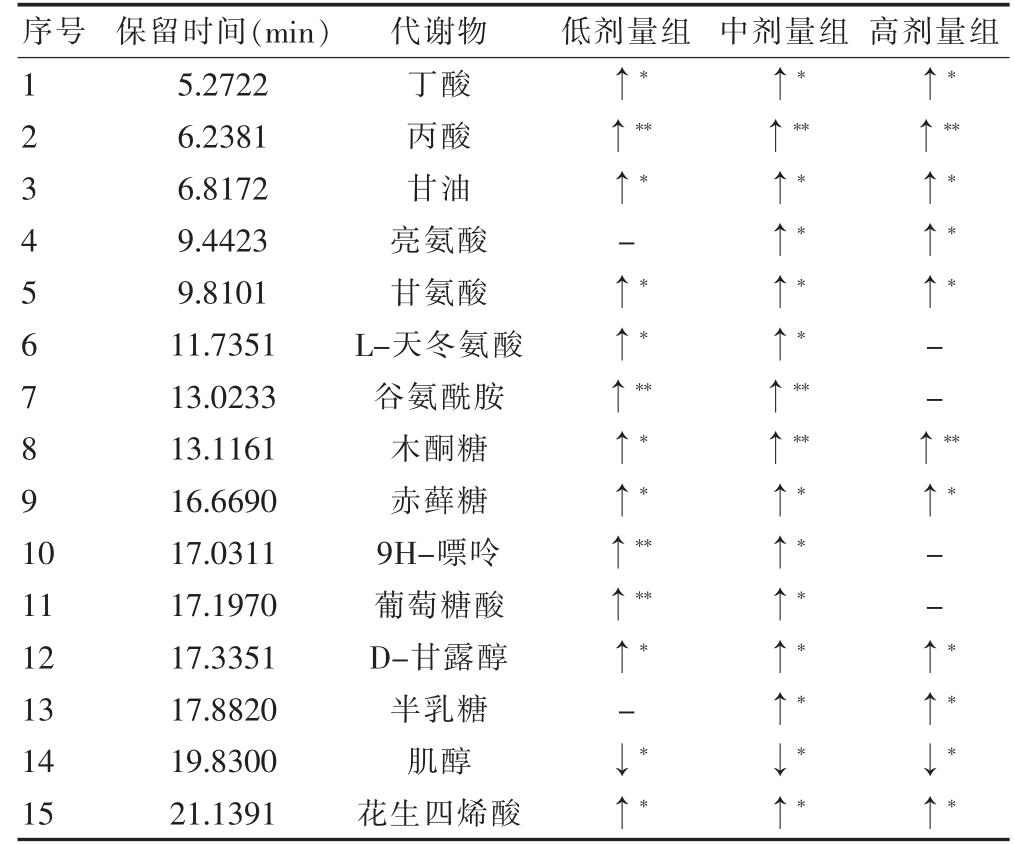
“↓”表示下降;“↑”表示升高;“-”表示无数据;与对照组比较,*P<0.05,**P<0.01
3 讨论
大剂量服用地芬诺酯(40~60 mg/次)会产生欣快感,长期使用可致依赖性。人最小致死剂量为200 mg/kg。为探讨地芬诺酯对大鼠的肝损伤过程,本研究比较了地芬诺酯组(低、中、高剂量组)和对照组的肝脏组织代谢组学差异。本研究中,丁酸、丙酸、9H-嘌呤、亮氨酸、甘氨酸和天冬氨酸是氨基酸代谢的产物,木酮糖、葡萄糖酸、D-甘露醇、半乳糖、甘油是能量代谢的中间产物。三羧酸循环(TCA)是三大营养素(碳水化合物、脂类、氨基酸)的最终代谢途径,这些化合物的变化表明TCA 的紊乱和机体代谢的异常[13-16]。TCA 的中间产物是一些生物合成的前体,它们提供了能量代谢的主要来源,提供氨基酸合成的前体。在肝损伤演化过程中由于能量代谢受到扰动以及蛋白质降解的增加,改变了大鼠肝组织中自由氨基酸的浓度。因此,氨基酸浓度会随着肝脏的不同状态而改变。甘氨酸是肝脏线粒体中乙酰辅酶A 的共轭氨基酸,其可以减轻肝脏细胞由于三磷酸腺苷(ATP)消耗引起的损伤。本研究中地芬诺酯组的甘氨酸含量升高,提示肝损伤过程中能量代谢受到扰动从而导致肝功能下降。另外地芬诺酯组大鼠肝组织中的亮氨酸、天冬氨酸升高,这与肝纤维化代谢组学研究结果一致[17]。其原因可能是由于肝损伤过程中扰动了蛋白质和氨基酸代谢的平衡。
肝脏作为能量代谢的重要器官之一,在机体碳水化合物和脂类代谢的调节中起着重要的作用。肌醇是半乳糖代谢的中间产物,地芬诺酯组肝组织中肌醇水平下降,提示肝功能损害。花生四烯酸是一种存在于细胞膜磷脂中的多不饱和脂肪酸,在大脑、肝脏和肌肉中含量丰富。地芬诺酯组大鼠肝组织中花生四烯酸含量的升高,与机体自身保护机制有关[18]。
综上所述,通过基于GC-MS 的代谢组学方法研究地芬诺酯给药后的大鼠肝组织代谢物变化,结果显示,对照组和给药组代谢物完全不同。这些代谢物与氨基酸代谢、脂类代谢和能量代谢有关。该研究为更好地了解地芬诺酯及其类似物在肝组织中的代谢机制提供了依据。
[参考文献]
[1]韩咏霞.小儿慎用复方地芬诺酯[J].医药与保健,2005,13(6):47.
[2]黄军军,荣右明,李荣成,等.甘肃省强制戒毒者复方地芬诺酯滥用现状及相关因素分析[J].中华流行病学杂志,2018,39(9):1222-1227.
[3]王达平,胡文生,丁毅,等.复方地芬诺酯片依赖11 例临床分析[J].中国药物依赖性杂志,2009,18(5):397-400.
[4]刘涛,周悦,杨子浩.复方地芬诺酯中毒的监护与护理[C].//中华医学会. 中华医学会急诊医学分会第十六次全国急诊医学学术年会论文集.2013:551-552.
[5]王静,袁子民,孔宏伟,等.基于气相色谱-质谱联用的代谢组学用于黄连治疗Ⅱ型糖尿病的机理探索[J].色谱,2012,30(1):8-13.
[6]王洋,孙梅.基于气相色谱-质谱联用技术对婴儿肝炎综合征的代谢组学研究[J].国际儿科学杂志,2018,45(7):537-542.
[7]俸家富.代谢组学技术在肾脏疾病诊疗中的发展[J].中华检验医学杂志,2018,41(3):246-250.
[8]崔艳艳,张彦婷,张璐玉,等.基于气相色谱-质谱联用技术的食管鳞癌细胞代谢组学分析[J].郑州大学学报(医学版),2019,54(4):485-488.
[9]Wen CC,Zhang ML,Zhang Y,et al.Brain metabolomics in rats after administration of ketamine[J].Biomed Chromatogra,2016,30(1):81-84.
[10]Waterman D,Horsfield B,Leistner F,et al.Quantification of polycyclic aromatic hydrocarbons in the NIST standard reference material (SRM1649A) urban dust using thermal desorption GC/MS[J].Anal Chem,2000,72(15):3563-3567.
[11]Zhang M,Deng M,Ma J,et al.An evaluation of acute hydrogen sulfide poisoning in rats through serum metabolomics based on gas chromatography-mass spectrometry[J].Chem Pharm Bull(Tokyo),2014,62(6):505-507.
[12]Craig A,Cloarec O,Holmes E,et al.Scaling and normalization effects in NMR spectroscopic metabonomic data sets[J].Ana Chem,2006,78(7):2262-2267.
[13]Sublette ME,Galfalvy HC,Fuchs D,et al.Plasma kynurenine levels are elevated in suicide attempters with major depressive disorder[J].Brain Behav Immu,2011,25(6):1272-1278.
[14]Schuster CR.History and current perspectives on the use of drug formulations to decrease the abuse of prescription drugs[J].Drug Alcohol Depend,2006,83 Suppl 1:S8-S14.
[15]Doerr A.Global metabolomics[J].Nat Methods,2017,14(1):32.
[16]Allen EL,Ulanet DB,Pirman D,et al.Differential aspartate usage identifies a subset of cancer cells particularly dependent on OGDH[J].Cell Rep,2016,17(3):876-890.
[17]Vila L,Rebollo A,Adalsteisson GS,et al.Reduction of liver fructokinase expression and improved hepatic inflammation and metabolism in liquid fructose-fed rats after atorvastatin treatment[J].Toxicol Appl Pharmacol,2011,251(1):32-40.
[18]Levine L.Nuclear receptor agonists stimulate release of arachidonic acid from rat liver cells[J].Prostag Leukotr Ess,2002,67(6):453-459.
Study on the effect of Diphenoxylate on liver tissue metabolism in rats based on GC-MS technology
XU Hui-fang
Department of Pharmacy, Zhuhai Maternal and Child Health Hospital, Guangdong Province, Zhuhai 519000, China
Department of Pharmacy, Zhuhai Maternal and Child Health Hospital, Guangdong Province, Zhuhai 519000, China
[Abstract]Objective To study the effect of Diphenoxylate on liver tissue metabolism in rats. Methods Thirty-two SD rats were randomly divided into four groups: Diphenoxylate administration group (low, medium, and high dose groups)and control group, with 8 rats in each group. The gas chromatography-mass spectrometry (GC-MS) of the liver tissue was collected and analyzed by partial least-squares discriminant analysis (PLS-DA) to identify different metabolites.Results Compared with the control group, the levels of these metabonomics in liver tissue such as butyric acid, propionic acid, glycerin, leucine, glycine, L-aspartic acid, glutamine, xylulose, erythrose, 9H-purine, gluconic acid, D-mannitol, galactose, and arachidonic acid increased, while the level of inositol myo-inositol decreased (P<0.05). Conclusion The changes of these metabolites indicate abnormalities in amino acid metabolism, lipid metabolism, and energy metabolism in rats after administration. This study can provide useful information for liver metabolism of Diphenoxylate.
[Key words] Metabolomics; Gas chromatography-mass spectrometry; Diphenoxylate; Hepatotoxicity
[中图分类号]R927.2
[文献标识码]A
[文章编号]1674-4721(2020)6(a)-0011-03
(收稿日期:2020-01-21 本文编辑:任秀兰)