金银花防治西妥昔单抗引起的皮肤毒性反应的临床研究
杜永丽1 罗丹谷1▲ 谭志博1 何家玲2
1.南方医科大学深圳医院肿瘤科,广东深圳 518110;2.中山大学附属第八医院肿瘤科,广东深圳 518033
[摘要]目的 探讨金银花液湿敷对西妥昔单抗引起的皮肤毒性反应的预防和治疗效果。方法 选取2016年7月~2018年4月南方医科大学深圳医院及中山大学附属第八医院的60 例接受西妥昔单抗联合化疗的结直肠癌初治患者作为研究对象,采用1∶1 比例随机将其分为试验组(30 例)和对照组(30 例)。试验组全程给予金银花液湿敷,4 次/d,对照组仅在发生Ⅲ度及以上皮肤毒性反应给予金银花液湿敷,单盲法观察记录两组皮肤毒性反应的发生情况。比较各级皮肤毒性反应的例数、发生时间、缓解比例。结果 试验组的整体皮肤毒性反应的严重程度低于对照组,差异有统计学意义(P<0.05)。在首次出现Ⅱ度皮肤毒性反应后,试验组中皮肤毒性反应不再继续加重的比例高于对照组,差异有统计学意义(P<0.05)。试验组首次出现Ⅱ度皮肤毒性反应的时间[(23.8±3.8)d]长于对照组[(15.1±3.2)d],差异有统计学意义(P<0.05);试验组中出现Ⅱ度皮肤毒性反应后不再继续加重的比例(68.2%)高于对照组(33.3%),差异有统计学意义(P<0.05);试验组和对照组Ⅲ度及以上皮肤毒性反应经金银花液湿敷治疗后得到缓解的比例(分别为71.4% 和72.7%),差异无统计学意义(P>0.05)。结论 金银花液湿敷可能对西妥昔单抗引起的皮肤毒性反应有较好的预防和治疗效果,但尚需大样本研究。
[关键词]金银花;西妥昔单抗;皮肤毒性反应;临床研究
在我国,结直肠癌的预期年发病率和死亡率均居于恶性肿瘤的前5 位,且均呈显著增长趋势[1]。约20%的结直肠癌患者在诊断时已发生远处转移[2]。西妥昔单抗联合化疗是转移性结直肠癌的标准治疗方案之一[3-6],但在治疗的患者中, 约80%会出现皮肤毒性反应,约12.1%的患者因此而停药[7-8]。目前临床上对西妥昔单抗引起的皮肤毒性反应的防治手段单一且疗效欠佳[9],因此, 寻找有效且经济的处理皮肤毒性反应的方法是临床迫切需要的。金银花为常用传统中药,具有清热解毒、凉散风热的功效[10-12]。少量文献[13-18]提示金银花在防治西妥昔单抗引起的皮肤毒性反应中发挥良好效果,但尚缺乏随机对照的临床试验,本研究拟通过Ⅱ期随机对照试验, 评价金银花对西妥昔单抗引起的皮肤毒性反应的防治效果,为其临床应用提供依据,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年7月~2018年4月南方医科大学深圳医院及中山大学附属第八医院的60 例经病理学证实为结直肠癌,且表皮生长因子受体(EGFR)及KRAS/N-RAS 无突变有远处转移的初治患者作为研究对象。纳入标准:①年龄25~70 岁;②体力状态评分0~1 分;③无主要器官功能障碍;④预期能完成试验。排除标准:①无完全行为能力,依从性差;②孕期及哺乳期女性;③入组前30 d 参加过药物临床试验;④有>1 级的外周神经病变或严重皮肤疾病者;⑤长期激素治疗者;⑥重症肌无力、闭角型青光眼、前列腺增生患者。剔除标准:①治疗中因西妥昔单抗的其他严重不良反应而终止使用者;②治疗中因其他药物(非西妥昔单抗)所致皮疹患者;③在疾病进展后使用其他单克隆抗体药物及激素药物者;④不遵循试验要求或中途要求退出该试验的患者。按1∶1 比例随机分为试验组(30 例)和对照组(30 例),两组中各有4 例因非皮肤毒性反应的其他严重不良反应而终止使用西妥昔单抗, 其余52 例顺利完成本研究。两组的一般资料(年龄、性别、ECOG 评分、TNM 分期)比较,差异无统计学意义(P>0.05)(表1),具有可比性。
表1 完成本研究的52 例患者的临床资料[n(%)]
.jpg)
1.2 方法
1.2.1 研究总体流程 试验组和对照组均给予西妥昔单抗(默沙东药业有限公司,生产批次207723、219265)联合化疗治疗,于首次化疗前1 周起给予,1 次/周,首次剂量为400 mg/m2,其后每次250 mg/m2;化疗给予FOLFOX 方案(奥沙利铂:默沙东药业有限公司,生产批次15I08、16F06、17C23;氟尿嘧啶:上海旭东海普药业有限公司,生产批次FA160301、FA161105;亚叶酸钙:重庆药友制药有限责任公司, 生产批次16081040、16081770),每两周1 次,共12 个周期。试验组在西妥昔单抗治疗起始时即使用金银花液湿敷, 而对照组在出现Ⅲ度或以上皮肤毒性反应时才开始使用金银花液湿敷。以西妥昔单抗联合化疗结束或出现不能耐受的毒性反应而停用西妥昔单抗作为研究终点(图1)。
1.2.2 金银花液湿敷的实施方案 金银花 (深圳一致药业股份有限公司, 生产批次151007、170601)10 g放入无菌用水200 ml 中,文火煮沸10 min,医用滤纸过滤后取滤液,室温冷却至30℃,用医用纱布浸入滤液中,将浸湿的纱布置于患者面颈部、胸背部,每次15 min,4 次/d。试验组和对照组的具体研究流程详见图2 和图3。
.jpg)
图1 研究的总体流程图
.jpg)
图2 试验组的具体研究流程和结局
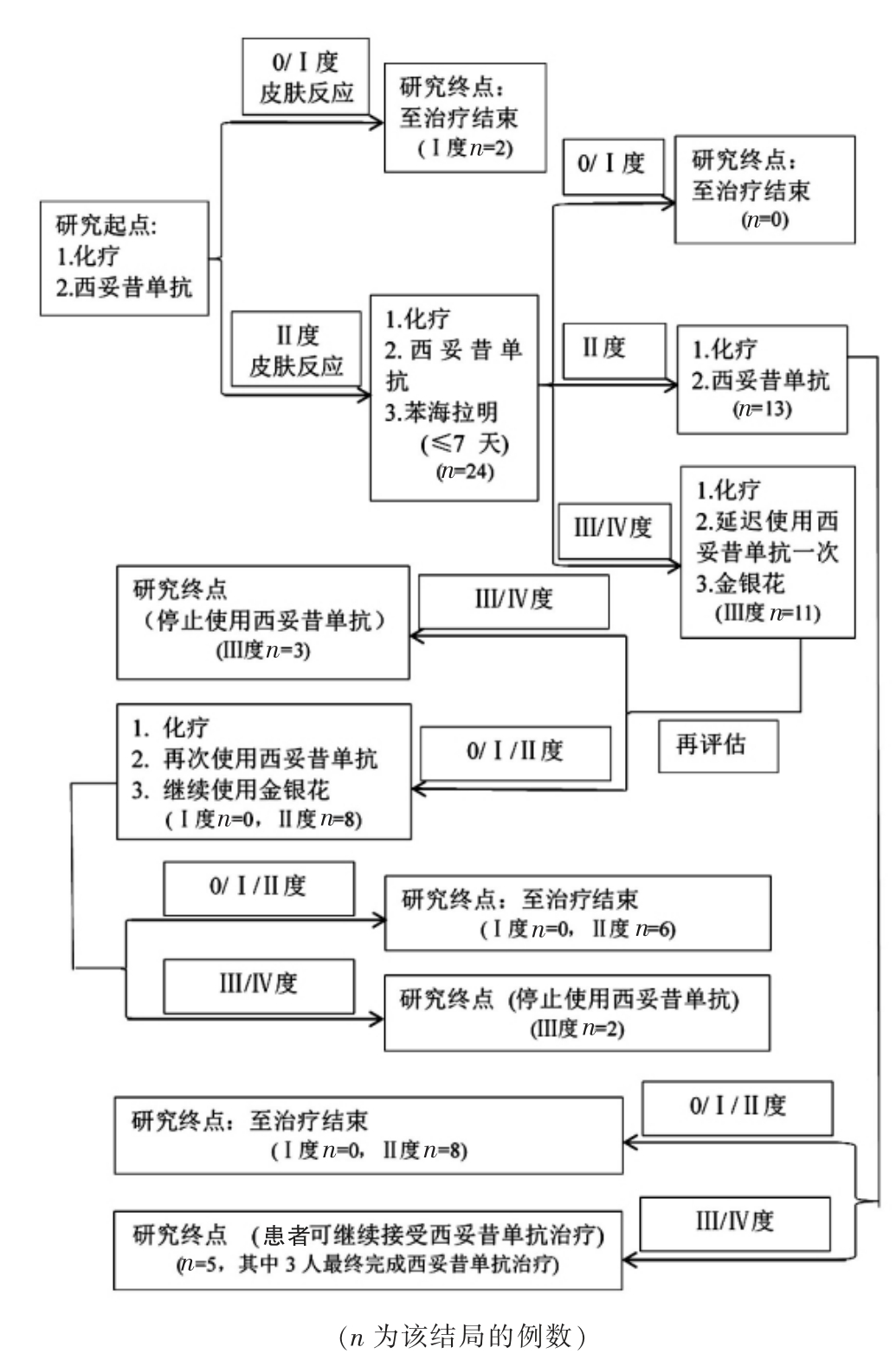
图3 对照组的具体研究流程和结局
1.3 观察指标与评价标准
由1 名不知分组情况的研究者每日观察入组的皮肤毒性反应的部位、程度,按NCI-CTCAE 4.0.3 版本的标准评价并记录。
1.4 统计学方法
采用SPSS 22.0 进行统计学分析, 对两组计量资料行双样本异方差t 检验, 计数资料行χ2 检验,等级资料采用秩和检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组皮肤毒性反应严重程度的比较
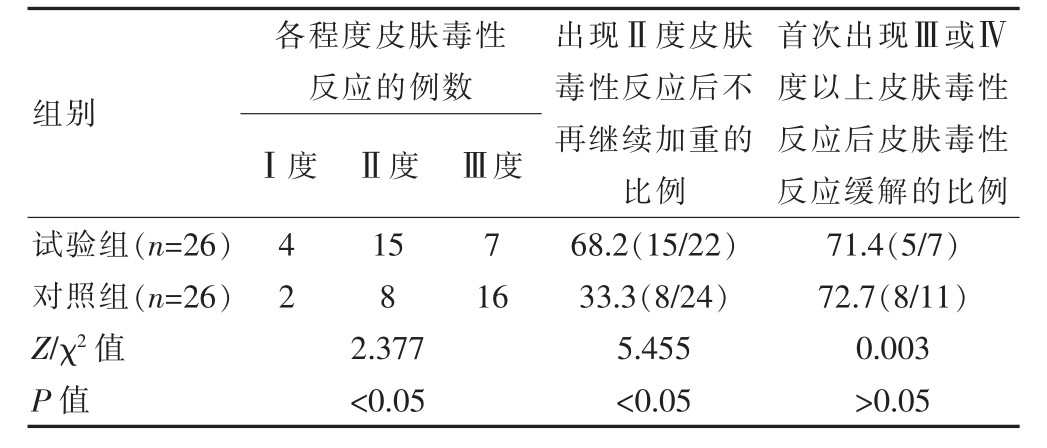
试验组的整体皮肤毒性反应的严重程度轻于对照组,差异有统计学意义(P<0.05)。在首次出现Ⅱ度皮肤毒性反应后,试验组中皮肤毒性反应不再继续加重的比例高于对照组,差异有统计学意义(P<0.05)。在首次出现度Ⅲ或Ⅳ度皮肤毒性反应后,两组中皮肤毒性反应得到缓解的比例比较, 差异无统计学意义(P>0.05)(表2)。
表2 两组皮肤毒性反应严重程度的比较[n(%)]
2.2 两组皮肤毒性反应发生时间的比较
试验组首次出现任何程度的皮肤毒性反应的时间长于对照组,差异有统计学意义(P<0.05);者首次出现Ⅱ皮肤毒性反应的时间长于对照组, 差异有统计学意义(P<0.05);试验组首次出现Ⅲ度及以上的皮肤毒性反应的时间长于对照组, 差异有统计学意义(P<0.05)。试验组和对照组中,部分病例的皮肤毒性反应从Ⅱ度进展至Ⅲ度及以上, 试验组的进展时间长于对照组,差异有统计学意义(P<0.05)。试验组和对照组中, 部分病例的皮肤毒性反应从Ⅲ度减轻至Ⅱ度,两组的缓解时间比较,差异无统计学意义(P>0.05)(表3)。
表3 两组皮肤毒性反应发生时间的比较(d,.jpg) ±s)
±s)

与对照组比较,*P<0.05
3 讨论
既往研究发现,EGFR 在皮肤的基底层、皮脂腺和毛囊外根鞘等处高表达[20],西妥昔单抗作为一种EGFR抑制剂, 可竞争性阻断表皮EGF 与皮肤EGFR 的结合,引起皮肤基底角质细胞生长停滞、过早分化和凋亡,诱导中性粒细胞释放炎性介质[21],并可继发感染,形成丘疹脓疱型皮疹、甲床炎等[22]。而金银花中的黄酮类物质能有效降低中性粒细胞对溶酶体酶的释放和合成[23],马钱素、忍冬甙等有与阿司匹林相当的抗炎活性[24],鞣酸、皂甙、肌醇等成分存在还原基团,具有较强的抑菌作用[25],因而,金银花可能以多重机制抑制西妥昔单抗引起的皮肤毒性反应。
本研究结果显示,试验组皮肤毒性反应的严重程度轻于对照组、出现时间长于对照组、进一步加重的比例低于对照组、进展时间长于对照组(P<0.05),提示金银花液湿敷对西妥昔单抗引起的皮肤毒性反应的发生发展具有较好的预防效果;结果还显示,当出现Ⅲ度及以上的皮肤毒性反应后,两组在使用金银花液湿敷后,大部分患者的皮肤毒性反应都能及时得到缓解,提示金银花液湿敷对西妥昔单抗引起的皮肤毒性反应也有较好的治疗效果。
本研究在设计和执行时,严格遵循西妥昔单抗药物使用说明和停药原则,并始终遵循不妨碍抗肿瘤治疗的原则,因而是符合伦理学要求的;本研究的设计流程,涵盖了金银花在皮肤毒性反应的预防和治疗两方面的作用,使研究数据更有说服力;西妥昔单抗广泛用于头颈部肿瘤及结直肠肿瘤的靶向治疗,本研究选取结直肠癌患者为研究对象,是为排除头颈部肿瘤患者放疗所致皮肤毒性反应而带来的研究偏倚。但本研究因样本量少可能导致结果偏倚。
综上所述,金银花液湿敷可能对西妥昔单抗引起的皮肤毒性反应有较好的预防和治疗效果,但尚需在大样本的人群中进行进一步研究。
[参考文献]
[1]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[2]Brenner H,Kloor M,Pox CP.Colorectal cancer[J].Lancet,2014,383(9927):1490-1502.
[3]Bokemeyer C,Van Cutsem E,Rougier P,et al.Addition of cetuximab to chemotherapy as first-line treatment for KRAS wild-type metastatic colorectal cancer: pooled analysis of the CRYSTAL and OPUS randomised clinical trials[J].Eur J Cancer,2012,48(10):1466-1475.
[4]Bokemeyer C,Bondarenko I,Makhson A,et al.Fluorouracil,leucovorin,and oxaliplatin with and without cetuximab in the first-line treatment of metastatic colorectal cancer[J].J Clin Oncol,2009,27(5):663-671.
[5]Maughan TS,Adams RA,Smith CG,et al.Addition of cetuximab to oxaliplatin-based first-line combination chemotherapy for treatment of advanced colorectal cancer: results of the randomised phase 3 MR COIN trial[J].Lancet,2011,377(9783):2103-2114.
[6]Chen D,Li L,Zhang X,et al.FOLFOX plus anti-epidermal growth factor receptor(EGFR)monoclonal antibody(mAb)is an effective first-line treatment for patients with RAS-wild left-sided metastatic colorectal cancer:a meta-analysis[J].Medicine(Baltimore),2018,97(10):e0097.
[7]Folprecht G,Hamann S,Schutte K,et al.Dose escalating study of cetuximab and 5-FU/folinic acid (FA)/oxaliplatin/irinotecan (FOLFOXIRI) in first line therapy of patients with metastatic colorectal cancer[J].BMC Cancer,2014,14:521.
[8]Price TJ,Peeters M,Kim TW,et al.Panitumumab versus cetuximab in patients with chemotherapy-refractory wild-type KRAS exon 2 metastatic colorectal cancer (ASPECCT):a randomised,multicentre,open-label,non-inferiority phase 3 study[J].Lancet Oncol,2014,15(6):569-579.
[9]Pinto C,Barone CA,Girolomoni G,et al.Management of skin toxicity associated with cetuximab treatment in combination with chemotherapy or radiotherapy[J].Oncologist,2011,16(2):228-238.
[10]杨欣,李洪波,陈诚,等.金银花药性与功效的文献考证[J].中国实验方剂学杂志,2010,16(18):220-222.
[11]邓霁玲.金银花的药理作用研究与实际临床应用分析[J].医药前沿,2017,7(2):284-285.
[12]王亚琼,陈卫,钟水生,等.金银花清热解毒作用的血清代谢组学研究[J].中药材,2016,39(5):1129-1133.
[13]张海霖,王国蓉,张仕碧,等.金银花液热湿敷防治放疗加西妥昔单抗致皮肤反应的效果观察[J].中华护理杂志,2010,45(4):307-310.
[14]龙小丽,黄艳,庞凡.金银花煎液外敷治疗西妥昔单抗致痤疮样皮疹[J].护理学杂志,2011,26(9):34.
[15]杨剑霞,孙丽凯.复方金银花煎液湿热敷联合夫西地酸乳膏外用治疗分子靶向药物所致皮疹的效果观察[J].护理学报,2015,22(2):61-62.
[16]容怡英,何湘子,丘小芬,等.金银花联合玫瑰果油治疗爱必妥致皮肤毒性反应的效果观察[J].护理学报,2010,26(S1):155.
[17]戎煜明,丘惠娟,林晓平,等.中药内服加金银花外用治疗西妥昔单抗引起的痤疮样皮疹[J].中药材,2017,40(10):2472-2474.
[18]武惠丽,李毅,宁晓云,等.复方金银花煎液湿热敷与夫西地酸乳膏联合治疗靶向药物所致皮疹的临床疗效[J].现代生物医学进展,2017,17(27):5258-5261.
[19]World Medical Association.World Medical Association Declaration of Helsinki:ethical principles for medical research involving human subjects[J].JAMA,2013,310(20):2191-2194.
[20]Nardone B,Nicholson K,Newman M,et al.Histopathologic and immunohistochemical characterization of rash to human epidermal growth factor receptor 1 (HER1)and HER1/2 inhibitors in cancer patients[J].Clin Cancer Res,2010,16(17):4452-4460.
[21]CunninghamD,HumbletY,SienaS,etal.Cetuximabmonotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer[J].N Engl J Med,2004,351(4):337-345.
[22]Lacouture ME,Lai SE.The PRIDE (Papulopustules and/or paronychia,regulatory abnormalities of hair growth,itching,and dryness due to epidermal growth factor receptor inhibitors)syndrome[J].Br J Dermatol,2006,155(4):852-854.
[23]庞瑞.金银花有效成分的药理学研究进展[J].陕西中医学院学报,2011,34(3):77-79.
[24]张百霞,周凤琴,郭庆梅.金银花中黄酮类化合物的研究进展[J].中国实验方剂学杂志,2012,18(23):2013-2014.
[25]陈继明,洪超群.金银花药理作用分析[J].亚太传统医药,2013,11(5):43-44.
[26]Lee GH,alietzis G,Askari A,et al.Is right-sided colon cancer different to left-sided colorectal cancer?-a systematic review[J].Eur J Surg Oncol,2015,41(3):300-308.
Clinical study on the prevention and treatment of Honeysuckle in skin toxicity induced by Cetuximab
DU Yong-li1 LUO Dan-gu1▲ TAN Zhi-bo1 HE Jia-ling2
1. Department of Oncology, Shenzhen Hospital of Southern Medical University, Guangdong Province, Shenzhen 518110, China; 2. Department of Oncology, the Eighth Affiliated Hospital of Sun Yat-sen University, Guangdong Province, Shenzhen 518033, China
1. Department of Oncology, Shenzhen Hospital of Southern Medical University, Guangdong Province, Shenzhen 518110, China; 2. Department of Oncology, the Eighth Affiliated Hospital of Sun Yat-sen University, Guangdong Province, Shenzhen 518033, China
[Abstract] Objective To evaluate the effect of Honeysuckle in preventing and curing skin toxicity induced by Cetuximab. Methods From July 2016 to April 2018, 60 patients with colorectal cancer treated by Cetuximab Plus chemotherapy in Shenzhen Hospital of Southern Medical University and the Eighth Affiliated Hospital of Sun Yat-sen University were selected as subjects, and randomly divided into experimental group (30 cases) and control group (30 cases) in a 1∶1 ratio. The experimental group was given Honeysuckle 4 times per day during the whole process, while Honeysuckle was administered in the control group only after the occurrence of skin toxicity of grade Ⅲor above. Single-blind method was used to record the occurrence of skin toxicity in two groups.The number of cases in each grade of skin toxicity,the occurrence time, the alleviation proportion in two groups were compared. Results The severity of skin toxicity in the experimental group was lower than that in the control group,the difference was statistically significant (P<0.05). After the first second degree of skin toxicity,the proportion of skin toxicity in the experimental group that did not continue to aggravate was higher that in the control group, the difference was statistically significant (P<0.05). The occurrence time of grade Ⅱskin toxicity in the experimental group([23.8±3.8]days)was longer than that in the control group([15.1±3.2]days),and the differences were statistically significant (P<0.05). The proportion of patients suffering from grade Ⅱskin toxicity that has not deteriorated in the experimental group (68.2%) was higher than that in the control group (33.3%), and the differences were statistically significant (P<0.05).The alleviation proportion of grade Ⅲskin toxicity or above in expe rimental group and control group (71.4% and 72.7% respectively) was statistically insignificant (P>0.05).Conclusion Honeysuckle may have a good effect on prevention and treatment of skin toxicity induced by Cetuximab, but it needs further studies with large samples.
[Key words] Honeysuckle; Cetuximab; Skin toxicity;Clinical trial
[中图分类号] R473.73
[文献标识码] A
[文章编号] 1674-4721(2019)3(c)-0214-05
[基金项目]广东省深圳市宝安区医疗卫生科研项目(2016CX 310)
[作者简介]杜永丽(1981-),女,四川泸州人,本科,主管护师,研究方向:肿瘤护理工作
▲通讯作者:罗丹谷(1982-),女,广东茂名人,本科,主管护师,护士长,研究方向:肿瘤临床与护理
(收稿日期:2018-07-12本文编辑:崔建中)