慢性阻塞性肺疾病合并肺栓塞的短期预后及危险因素分析
刘 翩1 卓玉娟2▲
1.重庆市江津中心医院呼吸科,重庆 402260;2.重庆市江津中心医院药剂科,重庆 402260
[摘要]目的 探讨慢性阻塞性肺疾病(COPD)合并肺栓塞(PE)的短期预后和危险因素,提高COPD 伴PE 的早期诊断率。方法 选择2014年1月~2018年7月我院收治的48 例COPD 合并PE 患者(栓塞组)和50 例慢性阻塞性肺疾病急性加重期(AECOPD)患者(对照组)作为研究对象进行研究,回顾性分析COPD 伴PE 的短期预后和危险因素。结果 两组患者的卧床时间≥3 d、下肢不对称水肿、胸痛、死亡率及D-二聚体、动脉血氧分压(PaO2)和N-末端脑钠尿肽前体(NT-proBNP)方面比较,差异有统计学意义(P<0.05);在栓塞组中,死亡者(n=9)的超敏肌钙蛋白(hs-TnT)和NT-proBNP 高于存活者(n=39),差异有统计学意义(P<0.05)。Logistic 回归分析结果显示,卧床时间≥3 d、下肢不对称水肿、D-二聚体≥2.0 μg/ml、PaO2<60 mmHg 及NT-proBNP≥1200 pg/ml 是COPD 合并PE 的危险因素(P<0.05)。结论 对于COPD 患者,如卧床时间≥3 d、下肢不对称水肿、D-二聚体≥2.0 μg/ml 或PaO2<60 mmHg、合并心功能不全时,应高度怀疑合并PE。若hs-TnT、NT- proBNP 明显增高,提示其短期预后差。
[关键词]慢性阻塞性肺疾病;肺栓塞;短期预后;危险因素
最近研究表明, 我国40 岁以上人群中慢性阻塞性肺疾病(COPD,简称“慢阻肺”)的患病率高达13.7%,全国患者总数约为1 亿[1]。慢阻肺急性加重期(AECOPD)因持续气流受限进一步加重,出现呼吸功能恶化,常表现为呼吸衰竭等症状。肺栓塞(PE)是由各种栓子阻塞肺动脉或分支所致,以肺循环和呼吸衰竭为主要生理特征[2],临床表现非特异性,发病率和死亡率高。COPD 易并发PE[3],国内研究发现,住院的COPD患者并发PE 概率为3.3%~33.0%[4]。临床上,当COPD并发PE 时,呼吸困难等症状常常被掩盖,很容易被忽视,一旦漏诊,患者的心肺功能快速恶化,病死率显著增高[5]。为提高COPD 合并PE 的早期诊断率,本研究回顾性分析我院COPD 合并PE 患者和单纯AECOPD 患者的临床资料, 探讨COPD 合并PE 的危险因素和短期预后因素,为区县医院早期诊断COPD 并发PE 提供依据,现报道如下。
1 资料与方法
1.1 一般资料
选择2014年1月~2018年7月重庆市江津中心医院收治的COPD 患者,将经CTPA 确诊为PE 的48例COPD 患者作为栓塞组,其中男34 例,女14 例;年龄51~86 岁,平均(70.3±5.7)岁。另选择50 例单纯AECOPD患者作为对照组,其中男38 例,女12 例;年龄51~85岁,平均(69.2±5.1)岁。两组患者在性别、年龄等方面比较,差异无统计学意义(P>0.05),具有可比性。所有患者均行肺功能及CTPA 检查;COPD 的诊断标准依据病史及肺功能检查结果。对照组患者,需要排除合并恶性肿瘤、冠心病、肾功能不全及其他呼吸系统疾病者,如气胸、支气管哮喘、胸腔积液。PE 的诊断标准:经CTPA 检查提示肺动脉阻塞或或充盈缺损。本研究经我院医学伦理委员会审核及同意,患者入组本研究前均知晓本研究情况并签署知情同意书。
1.2 方法
回顾性分析两组患者的临床资料。所有生化指标均采用患者入院24 h 内的抽血结果,对于24 h 内>1次检查,选择异常程度最高者;卧床≥3 d 为白天卧床时间>50%; 短期预后以住院期间及出院3 个月内死亡的例数计算死亡率。CTPA 采用德国西门子公司生产的Lightspeed V 型64 排螺旋CT 机;电化学发光法检测hs-TnT 和NT-proBNP 水平,免疫比浊法检测D-二聚体水平。
1.3 观察指标
比较两组患者的临床特征及生化指标, 包括:卧床时间≥3 d、下肢不对称水肿、呼吸困难、胸痛、咯血、晕厥、死亡的例数及白细胞计数(WBC)、血红蛋白(Hb)、D-二聚体、动脉血氧分压(PaO2)、动脉血二氧化碳分压(PaCO2)及超敏肌钙蛋白T(hs-TnT)、N-末端脑钠尿肽前体(NT-proBNP)检查结果。
1.4 统计学方法
采用SPSS 18.0 统计学软件进行数据分析, 计量资料用均数±标准差(.jpg) ±s)表示,两组间比较采用t 检验;计数资料采用率表示,组间比较采用χ2 检验,危险因素采用Logistic 回归分析,以P<0.05 为差异有统计学意义。
±s)表示,两组间比较采用t 检验;计数资料采用率表示,组间比较采用χ2 检验,危险因素采用Logistic 回归分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者临床特征的比较
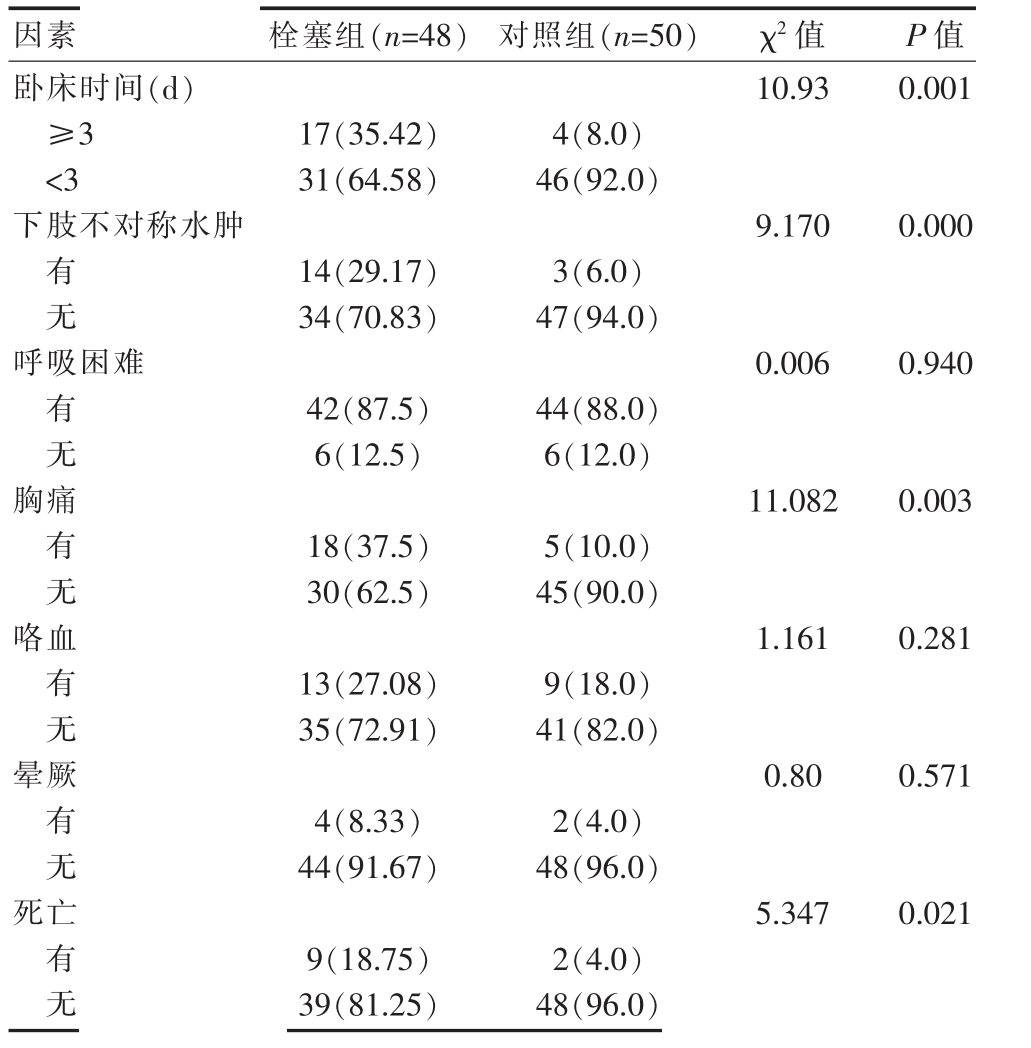
两组患者在呼吸困难、 咯血和晕厥方面比较,差异无统计学意义(P>0.05)。两组患者在卧床时间≥3 d、下肢不对称水肿、 胸痛构成比及死亡率方面比较,差异有统计学意义(P<0.05)。栓塞组中死亡9 例,死亡率为18.75%,高于对照组的4.0%,差异有统计学意义(P<0.05)(表1)。
表1 两组患者临床特征的比较[n(%)]
2.2 两组患者生化指标的比较
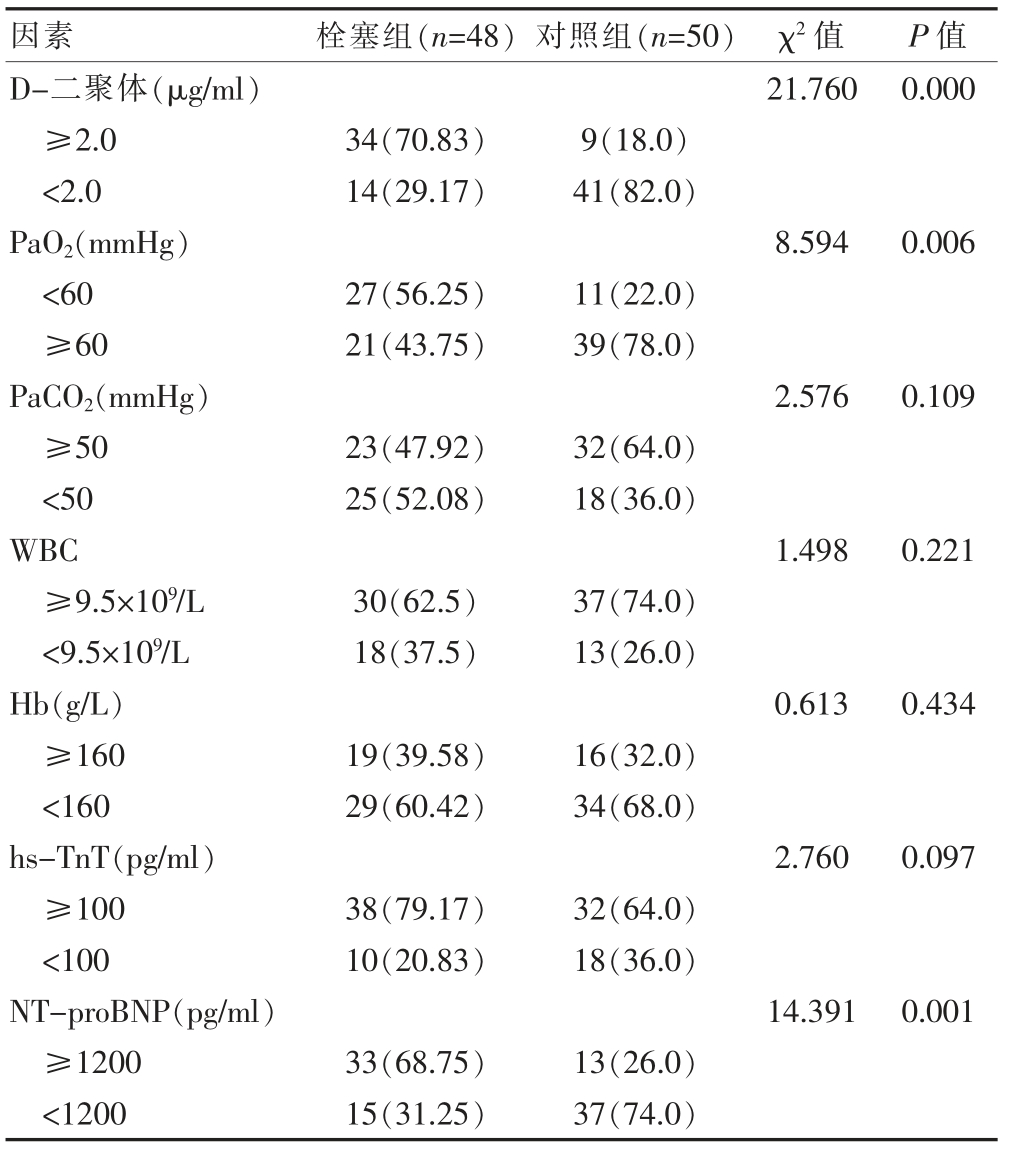
两组患者的D-二聚体、PaO2、NT-proBNP 比较,差异有统计学意义(P<0.05),而两组患者的PaCO2、WBC、Hb、hs-TnT 水平比较,差异无统计学意义(P>0.05)(表2)。
表2 两组患者生化指标的比较[n(%)]
2.3 COPD 合并PE 的Logistic 危险因素回归分析
对表1、表2 中存在统计学差异的因素进行Logistic 回归分析,进行回归分析时,慢阻肺合并PE 赋值为1,反之为0,为因变量;卧床≥3 d、下肢不对称水肿及胸痛为自变量,存在则赋值为1,不存在赋值为0;将D-二 聚 体≥2.0 μg/ml、PaO2<60 mmHg 及NTproBNP≥1200 pg/ml 赋值为1,反之为0。
Logistic 回归分析结果显示, 卧床时间≥3 d、下肢不对称水肿、D-二聚体≥2.0 μg/ml、PaO2<60 mmHg及NT-proBNP≥1200 pg/ml 是COPD 合并PE 的危险因素(P<0.05)(表3)。
表3 COPD 合并PE 的Logistic 危险因素回归分析
![]()
2.4 栓塞组中不同预后患者D-二聚体、hs-TnT、NTproBNP 的比较
在栓塞组中,死亡者(n=9)的hs-TnT 和NT-proBNP 高于存活组(n=39),差异有统计学意义(P<0.05)(表4)。
表4 栓塞组中不同预后患者D-二聚体、hs-TnT、NT-proBNP 的比较(.jpg) ±s)
±s)

与存活组比较,*P<0.05
3 讨论
国外文献报道,COPD 并发PE 的死亡率为6.8%,比未并发PE 患者高70%,出院3 个月内病死率达12%~13%[6-7]。本研究结果提示,栓塞组患者院内及出院3 个月内死亡9 例,死亡率为18.75%,高于对照组的4.0%,差异有统计学意义(P<0.05)。与国外报道不一致,考虑存在选择偏倚,本研究选择的是住院患者,病情重,还可能因早期未意识到合并PE,导致入组的多为病情重的患者,再次体现提高COPD 并发PE 早期诊断率的重要性。
PE 是住院患者第三大常见死亡原因, 发病率及猝死率高[8],如早期积极治疗,死亡率可显著降低[9]。比较PE 的常见临床症状,两组患者在胸痛方面的发生率(37.5%,10.0%)比较,差异有统计学意义(P<0.05),而在咯血(27.08%,18%)、呼吸困难(87.5%,88%)等方面的发生率比较,差异无统计学意义(P>0.05)。与另一研究中的 “COPD 合并PE 比单纯COPD 的患者胸痛症状更常见,而感染迹象很少见”这一结果一致[10]。提示慢阻肺患者出现胸痛时需警惕合并PE, 同时不能因无咯血等典型症状而排除PE。
临床上最常见的PE 是肺血栓栓塞(PTE),栓塞的主要来源是深静脉血栓形成 (DVT),PTE 和DVT有共同的易患因素[2]。深静脉血栓形成常表现为患肢肿胀, 因此临床单侧肢体肿胀常提示深静脉血栓形成。长期卧床是深静脉血栓形成的高危因素[11]。由于行动不便,慢阻肺患者长期卧位或坐位、血流速度降低,且慢性缺氧引起红细胞增多及利尿剂的使用等因素,造成血液高凝状态,使慢阻肺并发DVT 及PE 风险增加。研究发现,慢阻肺并发PE 比没有慢阻肺的人群高4 倍[12],所以应重视慢阻肺合并PE 的可能性。本研究结果提示,卧床时间≥3 d、下肢不对称水肿、D-二 聚 体≥2.0 μg/ml、PaO2<60 mmHg 及NT-proB NP≥1200 pg/ml 是COPD 合并PE 的危险因素(P<0.05),与国内研究一致[13]。在体内缺氧的情况下,红细胞继发增多和血管通透性增高导致血液粘度增加和血流减慢,加上缺氧、酸中毒损伤内皮细胞、凝血系统活性增强及抗凝机制抑制等因素,诱导血栓前状态[14]。除低氧外,COPD 患者的血栓栓塞风险增加有许多其他机制,如全身炎症,氧化应激,内皮功能障碍和血栓形成状态[15]。
一项对629 例COPD 和低风险PE 患者进行十年的回顾性研究发现, 其中21%患有红细胞增多症,这与全因住院死亡率有关[16]。本研究中,两组患者的红细胞增多症比率(39.58%,32%)比较,差异无统计学意义(P>0.05), 可能与入组的患者并非都为低风险PE 及样本量较少等因素有关。
在其他生化指标方面,栓塞组与对照组的D-二聚体及NT-proBNP 比较,差异有统计学意义(P<0.05),回归分析显示在COPD 患者中,如D-二聚体≥2.0 μg/ml、NT-proBNP≥1200 pg/ml, 合并PE 概率明显增高,与国内研究一致[17]。D-二聚体对急性PE 敏感率高,但在肿瘤、感染、手术、创伤、出血等情况时都可产生纤维蛋白,D-二聚体也增加,因此特异性差;通常在D-二聚体<0.5 μg/ml 时,可以排除急性PE[18],但D-二聚体对中度和高危PE 患者的诊断价值还有待进一步研究[19]。
NT-proBNP 是心室压力的标志物,心室负荷增加时分泌增多。在PE 发生时,肺血管重塑等导致血管狭窄或闭塞,肺血管阻力增加,肺动脉压升高;此外,因缺氧及多种血管活性物质的释放也加重肺动脉压力,进而增加右心室壁张力,刺激NT-proBNP 分泌增多[2]。在未出现右心功能障碍的AECOPD 患者中,NTproBNP 增加不明显。NT-proBNP 升高与PE 患者死亡率相关,可用于评估PE 的预后[2,18]。TnT 是心肌损伤的特异性标志物, 急性PE 合并右心衰竭时TnT 增高,近年来,作为PE 的危险分层因素,hs-TnT 越高,表明PE 患者的预后越差[18]。其他文献也证实了TnT和BNP 在评估PE 预后中的价值[20]。本研究结果提示,栓塞组中, 住院期间及出院3 个月内死亡的9 例患者, 其hs-TnT、NT-proBNP 值明显高于另外39 例存活患者,差异有统计学意义(P<0.05),提示hs-TnT、NT-proBNP 异常增高可反映慢阻肺合并PE 的严重性, 对COPD 合并PE 的短期预后评估有一定价值。但hs-TnT、NT-proBNP 浓度水平对预后影响的临界值还需进一步研究。
综上所述,对于慢阻肺患者,当卧床时间≥3 d,出现下肢不对称水肿、D-二聚体≥2.0 μg/ml、PaO2<60 mmHg 或NT-proBNP≥1200 pg/ml 时,需进一步检查是否合并PE,以免延误治疗。
此外,本研究由于区县级医院早期对PE 认识、重视度不够及家属不配合等原因导致未行CTPA 检查,而部分患者意识到合并PE 时因病情重不宜搬动行CTPA 检查,因此确诊的PE 病例较少。我们期待多中心、大样本、规范化的进一步研究结论为提高慢阻肺合并PE 的诊治水平提供整改依据。
[参考文献]
[1]Wang C,Xu JY,Yang L.Prevalence and risk factors of chronicobstructivepulmonarydiseaseinChina(theChinaPulmonary Health [CPH] study):a national cross-sectional study[J].Lancet,2018,391(10131):1706-1717.
[2]中华医学会心血管病分会肺血管病学组.急性PE 诊断与治疗中国专家共识(2015)[J].中华心血管病杂志,2016,44(3):197-211.
[3]Sabit R,Thomas P,Shale DJ,et al.The effects of hypoxia on markers of coagulation and systemic inflammation in patients with COPD[J].Chest,2010,138(1):47-51.
[4]王芳,程兆忠,王镜銮,等.慢性阻塞性肺疾病急性加重期肺栓塞发生率的荟萃分析[J].中华医学杂志,2013,93(24):1868-1871.
[5]Bertoletti L,Quenet S,Mismetti P,et al.Clinical presentation and outcome of venous thromboembolism in COPD[J].Eur Respir J,2012,39(4):862-868.
[6]Piazza G,Goldhaber SZ,Kroll A,et al.Venous thromboembolism in patients with chronic obstructive pulmonary disease[J].Am J Med,2012,125(10):1010-1018.
[7]Monreal M,Munoz-Torrero JF,Naraine VS,et al.Pulmonary embolism in patients with chronic obstructive pulmonary disease or congestive heart failurel[J].Am J Med,2006,119(10):851-858.
[8]Tapson VF.Acute pulmonary embolism[J].N Engl J Med,2008,358(10):1037-1052.
[9]Dalen JE.Pulmonary embelism:what have we learned since Virchow?Natural history,pathophysiology,and diagnosis[J].Chest,2002,122(4):1440-1456.
[10]Akpinar EE,Hosgün D,Akpinar S,et al.Incidence of pulmonary embolism during COPD exacerbation[J].J Bras Pneumol,2014,40(1):38-45.
[11]孙葵葵,王辰,古力夏提.深静脉血栓形成的危险因素及临床分析[J].中华结核和呼吸杂志,2004,27(11):727-730.
[12]Chen WJ,Lin CC,Lin CY,et al.Pulmonary embolism in chronic obstructive pulmonary disease:a population-based cohort study[J].COPD,2014,11(4):438-443.
[13]卓婕,白澎,李莉,等.低氧血症是慢性阻塞性肺疾病急性加重期静脉血栓栓塞症的危险因素[J].中国呼吸与危重监护杂志,2011,10(2):112-115.
[14]Sneeboer MM,Majoor CJ,De KA,et al.Prothomotic state in patients with severe and prednisolone-dependent asthma[J].J Allergy Clin Immunol,2015,137(6):1727-1732.
[15]Mejza F,Lamprecht B,Nizankowska-Mogilnicka E,et al.Arterial and venous thromboembolism in chronic obstructive pulmonary disease:From pathogenic mechanisms to prevention and treatment[J].Pneumonol Alergol Pol,2015,83(6):485-494.
[16]Guo L,Chughtai AR,Jiang H,et al.Relationship between polycythemia and in-hospital mortality in chronic obstructive pulmonary disease patients with low-risk pulmonary embolism[J].J Thorac Dis,2016,8(11):3119-3131.
[17]李有霞,郑则广,刘妮,等.慢性阻塞性肺疾病急性加重伴肺动脉栓塞的危险因素分析[J].中华结核和呼吸杂志,2016,39(4):298-303.
[18]中华医学会呼吸病学分会肺栓塞与肺血管病学组.肺血栓栓塞症诊治及预防指南[J].中华医学杂志,2018,98(14):1060-1087.
[19]熊长明,郑亚国,何建军,等.2014 版欧洲心脏学会急性肺血栓栓塞症诊断治疗指南解读[J].中国循环杂志,2014,2(3):21-26.
[20]于丽娜,李琳,张劲松.肌钙蛋白T 和脑利钠肽对急性肺栓塞患者病情和预后评价的临床研究[J].南京医科大学报,2012,32(1):82-85.
Short-term prognosis and risk factors of chronic obstructive pulmonary disease complicated with pulmonary embolism
LIU Pian1 ZHUO Yu-juan2▲
1. Department of Respiratory, Jiangjin Central Hospital, Chongqing 402260, China; 2. Department of Pharmacy,Jiangjin Central Hospital, Chongqing 402260, China
1. Department of Respiratory, Jiangjin Central Hospital, Chongqing 402260, China; 2. Department of Pharmacy,Jiangjin Central Hospital, Chongqing 402260, China
[Abstract] Objective To study the short-term prognosis andrisk factors for acute pulmonary embolism (PE)in patients with chronic obstructive pulmonary disease (COPD), to improve the early diagnosis rate of COPD with PE. Methods Forty-eight patients with COPD complicated with PE (as embolization group) and 50 patients with acute exacerbation of chronic obstructive pulmonary disease (AECOPD) (as control group) admitted to our hospital from January 2014 to July 2018 were selected as subjects for the study. The short-term prognosis and risk factors of COPD with PE were analyzed retrospectively. Results The bed time which was more than 3 days, lower limb asymmetric edema, chest pain, mortality and D-dimer, arterial partial pressure of oxygen (PaO2) and N-terminal brain natriuretic peptide (NT-proBNP) were compared between the two groups, the differences were statistically significant (P<0.05). In the embolization group, the patients who died (n=9) of hypersensitive troponin T (hs-TnT) and NT-proBNP were higher than those of the survival(n=39), the differences were statistically significant (P<0.05). Logistic regression analysis results showed that bed time≥3 d, asymmetric edema of lower limbs, D-dimer ≥2.0 μg/ml, PaO2<60 mmHg and NT-proBNP ≥1200 pg/ml were risk factors for COPD with PE (P<0.05). Conclusion Patients with COPD have ahigher incidence of PE if they have the risk factors of immobilization ≥3 days, asymmetric edema of lower limbs, D-dimer ≥2.0 μg/ml or PaO2 <60 mmHg,and cardiac dysfunction. If the levels of hs-TnT and NT-proBNP are significantly increased, their short-term prognosis is poor.
[Key words] Chronic obstructive pulmonary disease; Pulmonary embolism; Short-term prognosis; Risk factors
[中图分类号] R563
[文献标识码] A
[文章编号] 1674-4721(2019)3(c)-0018-04
▲通讯作者
(收稿日期:2018-12-17本文编辑:孟庆卿)